
����Ŀ������50 kg�Ľ����˺�FeԪ��Լ2 g����Ҫ��Fe2����Fe3����ʽ�����������ڡ�Fe2���ױ����գ���ƶѪ�߲�������Ӧ���京Fe2����������(��FeSO4)������Vc����ʹʳ���е�Fe3��ת��ΪFe2����
�������о�������Fe2��![]() Fe3����ת�����ڹ���A�У�Fe2����_______��������B��Fe3����______����
Fe3����ת�����ڹ���A�У�Fe2����_______��������B��Fe3����______����
��VcʹFe3��ת��ΪFe2����VC����һ��������___________������____________�ԡ�
���𰸡���ԭ�� ������ ��ԭ�� ��ԭ
��������
�ٹ���A��FeԪ�صĻ��ϼ�����������B��FeԪ�صĻ��ϼ۽�����
��VcʹFe3��ת��ΪFe2����FeԪ�صĻ��ϼ۽�������Vc����һ������ijԪ�صĻ��ϼ�������
�ٹ���A��FeԪ�صĻ��ϼ���������Fe2������ԭ��������B��FeԪ�صĻ��ϼ۽�������Fe3����������������ԭ��
��ˣ�������ȷ��������ԭ������������
��VcʹFe3��ת��ΪFe2����FeԪ�صĻ��ϼ۽�������Vc����һ������ijԪ�صĻ��ϼ�������������ԭ�������л�ԭ����
��ˣ�������ȷ��������ԭ������ԭ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���ԭ��ص������У���ȷ���ǣ� ��
A.ԭ��صĸ����Ϸ�����ԭ��Ӧ
B.ԭ��ع���ʱ�����������ɸ�����������������
C.ԭ����У����������ĵ缫����һ�����ǽ�������
D.����кͷ�ӦҲ������Ƴ�ԭ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(POCl3)�������뵼����Ӽ������άԭ��,ʵ�����Ʊ�POCl3���ⶨ��Ʒ������ʵ��������£�
���Ʊ�POCl3��
������������Һ̬PCl3����ȡPOCl3,ʵ��װ��(���ȼ��г�������)��ͼ��ʾ��
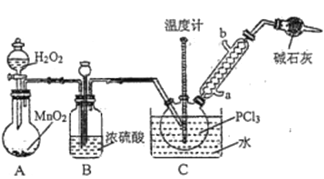
��֪����Ag++SCN-=AgSCN��;Ksp(AgCl)>Ksp(AgSCN);�������������ᡣ
��PCl3��POCl3�������Ϣ���±���
���� | �۵�/�� | �е�/�� | ��Է������� | ���� |
PCl3 | -112.0 | 76.0 | 137.5 | ������,��Ϊ��ɫҺ��,��ˮ�����ҷ�Ӧ���ɺ�������Ȼ��� |
POCl3 | 2.0 | 106.0 | 153.5 |
(1)POCl3��ˮ��Ӧ�Ļ�ѧ����ʽΪ_________________________________________��
(2)װ��B�����ó�����O2��,����_________________________________________������ܵ�������_______________��
(3)��Ӧ�¶�Ҫ������60~65��,ԭ����_____________________________________________��
�ⶨPOCl3��Ʒ�ĺ�����
ʵ�鲽�裺
���Ʊ�POCl3ʵ�������������ƿ�е�Һ����ȴ�����£�ȷ��ȡ30.7gPOCl3��Ʒ,����ʢ��60.00mL����ˮ��ˮ��ƿ��ҡ������ȫˮ��,��ˮ��Һ���100.00mL��Һ��
��ȡ10.00mL��Һ����ƿ��,����10.00mL3.2mol/LAgNO3����Һ��
�ۼ�����������������ҡ����ʹ�������汻�л��︲�ǡ�
����XΪָʾ��,��0.2mol/LKSCN��Һ�춨������AgNO3��Һ���ﵽ�ζ��յ�ʱ����ȥ10.00mLKSCN��Һ��
(4)������м�����������������___________________________________________�����˲���,�����Ʒ����Ԫ�ص�������������__________(�ƫ����ƫС�����䡱)��
(5)�������XΪ__________,��Ʒ��POCl3����������Ϊ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ��þ���Ͻ�����þ��������������8��9������200mLϡHNO3ʹ��ǡ����ȫ�ܽ⣬����NO�����ڱ�״���µ����Ϊ3.36L��Ȼ������Һ���ټ���NaOH��Һ�������������ٷ����仯�����ˡ�ϴ�ӡ����������
��1���Ͻ����������ʵ���Ϊ_________��������ó���������Ϊ_________��
��2����ȡ200 mLԭϡHNO3��300 mLϡ������ɻ��Һ�������м�ͭ��ʹ֮��ַ�Ӧ���õ�ֻ��һ�����ʵ���Һ��������ϡ��������ʵ���Ũ�ȡ���������̲����֣�____________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������з�Ӧ�У����������뻹ԭ����Ϊͬһ���ʵ���
A. Cl2��2NaOH===NaCl��NaClO��H2O
B. MnO2��4HCl(Ũ)![]() MnCl2��2H2O��Cl2��
MnCl2��2H2O��Cl2��
C. Fe��2HCl===FeCl2��H2��
D. KClO3��6HCl(Ũ)===KCl��3Cl2����3H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������MnO2����ŨHCl�ķ�Ӧ����ʽ���£�
��1��MnO2+4HCl��Ũ��![]() MnCl2+Cl2��+2H2O����MnO2��Cl2����������ǿ������˳���ǣ�______________________��
MnCl2+Cl2��+2H2O����MnO2��Cl2����������ǿ������˳���ǣ�______________________��
��2������˫���ŷ���������Ӧ�е���ת�Ƶķ������Ŀ_______________________
��3��Ũ�����ڷ�Ӧ����ʾ������������________�����ţ�
Aֻ�л�ԭ�� B��ԭ�Ժ����� Cֻ�������� D�����Ժ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����pCΪ��Һ���������ʵ���Ũ�ȵĸ���������:pC=-lgC��25��ʱ��ijŨ��H2Rˮ��Һ�У�pC(H2R)��pC(HR-)��pC(R2-)����ҺpH�ı仯������ͼ��ʾ������˵����ȷ����
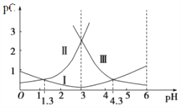
A. ����I������c(R2-)����pH�����������
B. pH=1.3ʱ��3c(R2-)+c(OH-)=10-1.3mol/L
C. �����£�����ϵ��c2(HR-)/ c(R2-)��c(H2R)=1000
D. NaHRˮ��Һ��:c(Na+)>c(HR-)>c(OH-)>c(H+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��ͪ��C3H6O��ͨ������ɫҺ�壬������ˮ���ܶ�С��1 gmL��1 �� �е�ԼΪ55�森Ҫ��ˮ���ͪ�Ļ�����н���ͪ������������з�������Ϊ�������ǣ�������
A.����
B.��Һ
C.����
D.����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������֤�����淴ӦN2(g)+3H2(g)![]() 2NH3(g)�Ѵﵽƽ��״̬����
2NH3(g)�Ѵﵽƽ��״̬����
��1��N![]() N�����ѵ�ͬʱ����3��H-H������ ��1��N
N�����ѵ�ͬʱ����3��H-H������ ��1��N![]() N�����ѵ�ͬʱ����6��N-H������ ��������������ʱ���������ƽ����Է����������ٸı� �ܺ��º���ʱ����ϵѹǿ���ٸı� ��NH3��N2��H2��������������ٸı� �����º���ʱ�����������ܶȱ��ֲ��� ������Ӧ����v(H2)=0.6mol/(L��min)���淴Ӧ����v(NH3)=0.4mol/(L��min)
N�����ѵ�ͬʱ����6��N-H������ ��������������ʱ���������ƽ����Է����������ٸı� �ܺ��º���ʱ����ϵѹǿ���ٸı� ��NH3��N2��H2��������������ٸı� �����º���ʱ�����������ܶȱ��ֲ��� ������Ӧ����v(H2)=0.6mol/(L��min)���淴Ӧ����v(NH3)=0.4mol/(L��min)
A. ȫ�� B. �ڢۢܢ� C. �ڢۢܢݢ� D. �ۢݢޢ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com