
在pH=1的溶液中,能大量共存的一组离子或分子是( )
A.Mg2+、Na+、ClO-、NO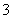
B.Al3+、NH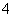 、Br-、Cl
、Br-、Cl -
-
C.K+、Cr2O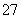 、CH3CHO、SO
、CH3CHO、SO
D.Na+、K+、SiO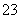 、Cl-
、Cl-
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
现将氯化铝溶液蒸干灼烧并熔融后用铂电极进行电解,下列有关电极产物的判断正确的是 ( )
A.阴极产物是氢气
B.阳极产物是氧气
C.阴极产物是铝和氧气
D.阳极产物只有氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
下列类比关系正确的是
A.钠与氧气在不同条件下反应会生成两种不同的氧化物,则Li与氧气反应也能生成Li2O或Li2O2
B.Na2O2与CO2反应生成Na2CO3和O2,则Na2O2与SO2反应可生成Na2SO3和O2
C.Fe与Cl2反应生成FeCl3,则Fe与I2反应可生成FeI3
D.Al与Fe2O3能发生铝热反应,则Al与MnO2也能发生铝热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.难溶电解质作比较时,Ksp小的,溶解度一定小
B.Ksp大小取决于难溶电解质的量,所以离子浓度改变时,沉淀溶解平衡会发生移动
C.所谓沉淀完全就是用沉淀剂将溶液中某一离子完全除去
D.温度一定,当溶液中Ag+和Cl-浓度的乘积等于Ksp时,溶液为AgCl的饱 和溶液
和溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
以水氯镁石(主要成分为MgCl2·6H2O)为原料生产碱式碳酸镁的主要
流程如下:
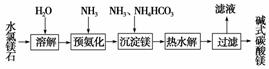
(1)预氨化过程中有Mg(OH)2沉淀生成,已知常温下Mg(OH)2的Ksp=1.8×10-11,若溶液中c(OH-)=3.0×10-6 mol·L-1,则溶液中c(Mg2+)=________。 (2)上述流程中的滤液浓缩结晶,所得主要固体物质的化学式______________________
(3)高温煅烧碱式碳酸镁得到MgO。取碱式碳酸镁4.66 g,高温煅烧至恒重,得到固体2.00 g和标准状况下CO2 0.896 L,通过计算确定碱式碳酸镁的化学式。
(4)若热水解不完全,所得碱式碳酸镁中将混有MgCO3,则产品中镁的质量分数________(填“升高”、“降低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,按下列物质的量关系进行反应,其对应的离子方程式或化学方程式书写正确的是 ( )。
A.n(Cl2)∶n(Fe)=5∶4
5Cl2+4Fe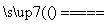 2FeCl2+2FeCl3
2FeCl2+2FeCl3
B.n(Cl2)∶n(FeBr2)=1∶1
Fe2++2Br-+Cl2===Fe3++Br2+2Cl-
C.n(MnO4-)∶n(H2O2)=2∶3
2MnO4-+3H2O2+6H+===2Mn2++4O2↑+6H2O
D.n(Fe)∶n[HNO3(稀)]=1∶3
4Fe+12H++3NO3-===3Fe2++Fe3++3NO↑+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
如右图,在左试管中先加入2mL 95%的乙醇,并在摇动下缓缓加入3mL浓硫酸,再加入2 mL乙酸,充分摇匀。在右 试管中加入5mL饱和Na2CO3溶液。按图连接好装置,用酒精灯对右试管小火加热3~5min后,改用大火加热,当观察到左试管
试管中加入5mL饱和Na2CO3溶液。按图连接好装置,用酒精灯对右试管小火加热3~5min后,改用大火加热,当观察到左试管
中有明显现象时停止实验。
(1)写出左试管中主要反应的方程式: ;
(2)加入浓硫酸的作用:___________________ _;
(3)饱和Na2CO3溶液的作用是: _____________________________;
(4)反应开始时用酒精灯对左试管小火加热的原因是: ;(已知乙酸乙酯的沸点为77℃;乙醇的沸点为78.5℃;乙酸的沸点为117.9℃)
(5)分离右试管中所得乙酸乙酯和Na2CO3溶液的操作为(只填名称) ,所需主要仪器为 。
(6)实验生成的乙酸乙酯,其密度比水 ,有 气味。
查看答案和解析>>
科目:高中化学 来源: 题型:
反应H2(g)+ I2(g)  2HI(g)在体积固定的密闭容器中进行,达到平衡状态的标志是( )
2HI(g)在体积固定的密闭容器中进行,达到平衡状态的标志是( )
①单位时间内断裂n mol H-H键的同时形成2n mol H-I键 ②单位时间内生成n molI2的同时生成2n molHI ③2v正(H2)=v逆(HI) ④HI分子数不再改变 ⑤混合气体颜色不再改变 ⑥混合气体压强不再改变
A. ②④⑤⑥ B.②③④⑤ C.①③④⑤ D.全部
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com