
 现有AlCl3和FeCl3混合溶液,其中Al3+和Fe3+的物质的量之和为0.1mol,在此溶液中加入90mL浓度为4mol/L的NaOH溶液,使其充分反应,设Al3+的物质的量与总物质的量的比值为x.
现有AlCl3和FeCl3混合溶液,其中Al3+和Fe3+的物质的量之和为0.1mol,在此溶液中加入90mL浓度为4mol/L的NaOH溶液,使其充分反应,设Al3+的物质的量与总物质的量的比值为x.分析 (1)因为Fe(OH)3的溶度积更小,更容易沉淀,所以Fe(OH)3先沉淀,当Fe3+ 反应完全,Al3+ 再开始沉淀,当Al(OH)3沉淀完全,NaOH加过量,Al(OH)3开始溶解Al3+与剩余OH-比例为1:4时,沉淀完全溶解为AlO2-、当Al3+、Fe3+ 比例为2:5,那么Al3+ 有0.04mol,Fe3+ 有0.06mol、NaOH有0.36mol,那么Fe3+ 完全沉淀消耗0.18mol,剩余的OH-物质的量大于0.16mol,Al3+ 全部转为AlO2-,所以沉淀只有0.06molFe(OH)3;
(2)一种情况是Fe3+ 与所有完全沉淀,需要0.12molFe3+,所以不成立,另一种情况是Al3+ 全部转为AlO2-,那么Al3+ 有0.1Xmol,Fe3+ 有0.1×(1-X)mol,那么氢氧化钠完全反应时X最大,4×0.1Xmol+3×0.1×(1-X)mol=0.36mol,解得X=0.6mol;采用极限的方法进行解答;沉淀只有Fe(OH)3,计算沉淀Fe(OH)3的物质的量,沉淀中含有氢氧化铝时,沉淀总量=氢氧化铁的物质的量+与铝离子等物质的量的氢氧化铝的物质的量-0.02mol氢氧化钠溶解的氢氧化铝的物质的量,据此数据画出沉淀总量随x的变化曲线;
解答 解:(1)①n(Al3+)+n(Fe3+)=0.1mol
$\frac{n(A{l}^{3+})}{n(A{l}^{3+})+n(F{e}^{3+})}$=0.4
得 n( Al3+ )=0.04mol,n(Fe3+)=0.06mol
Fe3++3OH-=Fe(OH)3
1 3 1
0.06mol n=0.18mol n=0.06mol
剩余n(OH-)=4mol/L×0.09L-0.18mol=0.18mol
Al3++4OH-=AlO2-+2H2O
1 4
0.04mol n=0.16mol<0.18mol
说明OH-离子有剩余,则Al3+全部生产偏铝酸根;
溶液中产生的沉淀是Fe(OH)3,物质的量为0.06mol;
答:溶液中产生的沉淀是Fe(OH)3,其物质的量是0.06mol;
(2)n(Al3+)+n(Fe3+)=0.1mol
$\frac{n(A{l}^{3+})}{n(A{l}^{3+})+n(F{e}^{3+})}$=x
得 n(Al3+)=0.1x,n(Fe3+)=0.1-0.1x
Fe3++3OH-=Fe(OH)3
1 3
0.1-0.1x n=0.3-0.3x
剩余n(OH-)=4mol/L×0.090L-(0.3-0.3x)mol=0.06+0.3x
Al3++4OH-=AlO2-+2H2O
1 4
0.04 n=0.4x 对照题(1)的情况,n(也就是0.4x)必须小于等于剩余的 n(OH-)时,即0.4x<0.06+0.3x时Al3+才会全部生产偏铝酸根,得x<0.6,x大于0混合液所以肯定有Al3+,x肯定大于0,当沉淀只有Fe(OH)3时,x的取值范围是0<X≤0.6;
在0≤x≤0.6时,沉淀只有Fe(OH)3,Fe(OH)3沉淀量为0.1mol×(1-x)=0.1mol-0.1xmol,
0.6≤x≤1时,沉淀总量为:0.1mol×(1-x)+0.1mol×x-(0.36mol-0.1mol×3)=0.04mol,所以图象为: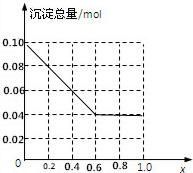 ,答:沉淀中只有Fe(OH)3时的x的取值范围是0≤x≤0.6,图中沉淀总量(mol)随x(0→1)变化的曲线为:
,答:沉淀中只有Fe(OH)3时的x的取值范围是0≤x≤0.6,图中沉淀总量(mol)随x(0→1)变化的曲线为: .
.
点评 本题考查混合物的有关计算,难度较大,清楚反应的过程是解题的关键,注意判断铝离子是否沉淀的特殊点.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
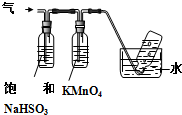
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,正向反应速率增加,逆向反应速率减小 | |
| B. | 达到平衡后,充入氦气,反应速率增大 | |
| C. | 达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动 | |
| D. | 达到平衡后,增大A2(g)的浓度,B2的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
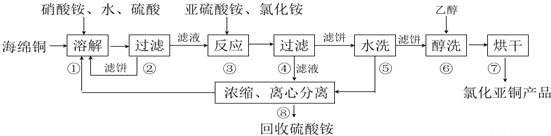
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+、Na+、SO42- | B. | K+、H+、HCO3- | C. | Cu2+、NO3-、SO42- | D. | Ba2+、NO3-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
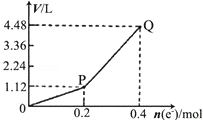
| A. | 电解过程中,溶液的pH不断增大 | |
| B. | Q点对应的气体中,H2与O2的体积比为2:1 | |
| C. | 阳极电极反应式为2H2O+4e-═4H++O2↑ | |
| D. | 当转移0.4mole-时,电解生成的铜为6.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2C2O4在反应中作还原剂 | |
| B. | 该反应中氧化产物与还原产物的物质的量之比为1:1 | |
| C. | KClO3在反应中得到电子 | |
| D. | 1 molKClO3参加反应有2mol电子转移 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com