
分析 (1)浸取还原过程的产物之一是VOSO4,据流程图和氧化还原剂原理,可写出反应的化学方程式;
(2)反萃取使用的硫酸用量过大,就需要用碱来中和;根据氨气能够使湿润的红色湿润试纸变蓝分析;
(3)根据n=$\frac{m}{M}$计算出该沉淀的物质的量,得到的残留固体为V2O5,碱石灰吸收的为水、浓硫酸吸收的为氨气,根据题中数据计算出各分解产物的物质的量,再得出该沉淀的化学式即可.
解答 解:(1)浸取还原过程的产物之一是VOSO4,V化合价为+4,据是还原过程可得原反应物是更高价的V,即为V2O5,反应的化学方程式为:Na2SO3+V2O5+2H2SO4=2VOSO4+Na2SO4+2H2O,
故答案为:Na2SO3+V2O5+2H2SO4═2VOSO4+Na2SO4+2H2O;
(2)反萃取使用的硫酸用量过大,就需要用氨水中和,则会增加氨水的用量;氨水能使湿润的红色石蕊试纸变蓝,则通常用红色的石蕊试纸检验氨气,
故答案为:NH3•H2O;红色的石蕊试纸;能使湿润的红色石蕊试纸变蓝;
(3)59.8g沉淀的物质的量为:$\frac{59.8g}{598g/mol}$=0.1mol;
取沉淀59.8g充分焙烧,得固体残留物54.6g,该残留物为V2O5,其物质的量为:n(V2O5)=$\frac{54.6g}{182g/mol}$=0.3mol;
所得气体通过碱石灰,减少的1.8g为水,水的物质的量为:n(H2O)=$\frac{1.8g}{18g/mol}$=0.1mol,
剩余气体能被稀硫酸完全吸收,硫酸稀释的为氨气,氨气的物质的量为:n(NH3)=$\frac{59.8g-54.6g-1.8g}{17g/mol}$=0.2mol,
n(H)=2n(H2O)+3n(NH3)=0.8 mol、n(O)=n(H2O)+5n(V2O5)=1.6 mol,
该沉淀的化学式中含有V、N、H、O的数目分别为:N(V)=$\frac{0.3mol×2}{0.1mol}$=6、N(N)=$\frac{0.2mol}{0.1mol}$=2、N(H)=$\frac{0.8mol}{0.1mol}$=8、N(O)=$\frac{1.6mol}{0.1mol}$=16,
所以该沉淀的化学式为:V6N2H8O16,
答:该沉淀的化学式为V6N2H8O16.
点评 本题考查了工业制硫酸的原理及化学方程式的计算,题目难度中等,明确工业制硫酸的原理为解答关键,注意掌握根据化学方程式进行计算的方法,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 用惰性电极电解饱和食盐水,每转移1mol电子,生成11.2L的H2 | |
| B. | 1molMg与足量的N2完全反应时,转移的电子数为3NA | |
| C. | 精炼铜时,当阳极质量减少6.4g时,电路中转移电子数为0.2NA | |
| D. | 常温下,11.2L的甲烷气体中含有的氢、碳原子数之比为4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若t℃时,0.05mol•L-1的Ba(OH)2溶液pH=11,t=25℃ | |
| B. | 常温下,向pH=a的醋酸溶液中加入等体积等浓度的硫酸后,pH=a+1 | |
| C. | 常温下,若c1mol•L-1的氨水与c2mol•L-1的盐酸等体积混合pH=7,则c1>c2 | |
| D. | 等体积等pH的CH3COOH溶液、盐酸分别与足量铝粉反应,盐酸生成H2的量更多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | n(Ca2+)增大 | B. | c(Ca2+)不变 | C. | n(OH-)增大 | D. | c(OH-)减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
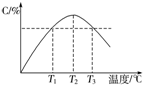
| A. | 0~5 min,C物质的平均反应速率为0.04 mol•L-1•min-1 | |
| B. | 图中温度T1时的正反应速率等于温度T3时的正反应速率 | |
| C. | 该反应温度T2时的平衡常数大于温度T3时的平衡常数 | |
| D. | 图中T2时,若只增大压强,则正、逆反应速率不改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知:25℃时,下列4种溶液.请回答下列问题.
已知:25℃时,下列4种溶液.请回答下列问题.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com