
| R | 原子最外层电子数是电子总数的$\frac{2}{3}$ |
| X | 单质不能将比它不活泼的金属从其盐溶液中置换出来 |
| Y | 第三周期原子半径最小的金属 |
| Z | 单质是淡黄色固体 |
| A. | R的最高价氧化物既能与某种非金属单质反应,又能与某种金属单质反应 | |
| B. | X、Y、Z的氧化物分别投入NaOH溶液中一定都能发生反应 | |
| C. | X、Y、Z的原子半径依次减小,离子半径依次增大 | |
| D. | X、Y、Z的最高价氧化物对应水化物之间可以两两反应 |
分析 R的原子最外层电子数是电子总数的$\frac{2}{3}$,应为C元素,X单质不能将比它不活泼的金属从其盐溶液中置换出来,应为活泼金属,且易与水反应,应为Na元素,Y是第三周期原子半径最小的金属,应为Al,Z单质是淡黄色固体,为S,以此解答该题.
解答 解:由以上分析可知R为C、X为Na、Y为Al、Z为S元素.
A.二氧化碳可与C、Mg等反应,故A正确;
B.二氧化碳可与氢氧化钠反应生成碳酸钠,氧化铝为两性氧化物,可与氢氧化钠溶液反应生成偏铝酸钠,二氧化硫可与氢氧化钠溶液反应生成亚硫酸钠,故B正确;
C.核外电子排布相同的离子,核电荷数越大离子半径越小,铝离子半径小于钠离子半径,故C错误;
D.氢氧化铝为两性氢氧化物,可与强酸、强碱反应,则X、Y、Z的最高价氧化物对应水化物之间可以两两反应,故D正确.
故选C.
点评 本题考查原子结构及元素周期律,为高频考点,把握原子结构、元素的位置推断元素为解答的关键,侧重分析与应用能力的考查,注意元素周期律的应用,题目难度不大.


科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | SO2、Cl2都可用于漂白物质,将等物质的量的两种气体同时作用于潮湿的有色布条时,可以增强漂白效果 | |
| B. | SO2能使品红溶液、溴水和酸性高锰酸钾溶液褪色,是因为SO2具有漂白性 | |
| C. | SO2通入紫色石蕊溶液中,溶液只变红不褪色 | |
| D. | Cl2通入紫色石蕊溶液中,溶液先变红后褪色. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
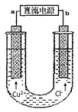
| A. | a端是直流电源的负极 | |
| B. | 通电使CuCl2发生电离 | |
| C. | 阴极上发生的反应:Cu2++2e-=Cu | |
| D. | 通电后,在阳极附近可观察到黄绿色气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 羟基和烃基直接相连接的化合物一定属于醇类 | |
| B. | 分子内有苯环和羟基的化合物一定是酚类 | |
| C. | 醇类的官能团是跟烃基(除苯环外)的碳原子相连的羟基 | |
| D. | 醇类和酚类具有相同的官能团,因而具有相同的化学性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn(s)+CuSO4(aq)═ZnSO4(aq)+Cu(s)放热反应 | |
| B. | 2CO(g)+O2(g)═2CO2(g) 放热反应 | |
| C. | CaCO3(s)═CaO(s)+CO2(g)吸热反应 | |
| D. | H+(aq)+OH-(aq)═H2O(l)放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2LSO3所含的分子数为0.5NA | |
| B. | 12g石墨和C60的混合物中质子总数一定为6NA | |
| C. | 25℃时,1L mol•L-1FeCl3溶液中含有0.1NA个Fe(OH)3胶体粒子 | |
| D. | 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com