
��12�֣�Fe��Ca����Ҫ�Ľ���Ԫ�ء�������ѧ֪ʶ���ش��������⡣
��1�����ӹ�ҵ����30%��FeCl3��Һ��ʴ���ھ�Ե���ϵ�ͭ��������ӡˢ��·�塣��д��FeCl3��Һ��ͭ��Ӧ�����ӷ���ʽ�� ��
��2��ij�о���ѧϰС��Ϊ�ⶨFeCl3��ʴͭ��������Һ����ɣ�����������ʵ�飺
��ȡ����������Һ������KSCN��Һ�ʺ�ɫ��������˵������Һ�к��е������� ��
����֤����Һ�к���Fe2+����ȷ��ʵ�鷽���� ��
A��ȡ������Һ���������Ը��������Һ������ɫ��֤������Fe2+
B��ȡ������Һ��������ˮ���ٵ���KSCN��Һ������Ѫ��ɫ��֤��ԭ��Һ�к���Fe2+
C���۲���Һ�Ƿ��dz��ɫ
��3����Ԫ�����������ij���Ԫ�أ����е�ϸ������Ҫ��Ԫ�ء���������ѪҺ��Ca2+Ϊ2.2��10-3~2.7��10-3 mol��L-1���ֳ�ȡij��Ѫ��10ml��ϡ�ͺ��ò����[(NH4)2C2O4]��Һ������ʹCa2+��ȫת��Ϊ�����CaC2O4���������ˣ�ϴ�ӣ����õ��ij�����ϡ�����ܽ�ɵõ����ᣨH2C2O4��������2.0ml 5.0��10-3 mol��L-1KMnO4��Һ���ܽ�õ��IJ���ǡ����ȫ��Ӧ���ݴ˿������ѪҺ�е�Ca2+��Ũ�ȣ����ж���ѪҺ�������Ƿ�������
����ʾ2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2+8H2O��
������5.0��10-3 mol��L-1 KMnO4 200mL��Һ����Ҫ��ȡKMnO4����������� g��
��ÿ���IJ���0.5mol��ת�Ƶ��ӵ����ʵ���Ϊ mol��
�۴���ѪҺ�е�Ca2+��Ũ��Ϊ mol��L-1��
��1��Cu+2Fe3+=Cu2++2Fe2+
��2����Fe3+��A
��3����0.158��1��2.5��10-3
��������
�����������1��ͭ���Ȼ�����Ӧ�����Ȼ�ͭ���Ȼ����������ӷ���ʽΪ��Cu+2Fe3+=Cu2++2Fe2+����2����ֻ���������������軯���Ժ�ɫ������˵����Һ�к���Fe3+����A������������ʹ���Ը��������Һ��ɫ������ѡA��B���ȵ�����ˮ���ٵ������軯�أ��Ժ�ɫ������˵��ԭ��Һ�����������ӣ���Ϊԭ��Һ�й��������ӣ����Բ�ѡB��C����Һ���������ӣ���dz��ɫ��������Һ����ɫ�����������Բ�ѡC����ѡA����3���ٸ�����ص�����Ϊ5.0��10-3��200��10-3��158=0.158�ˡ��ڸ��ݷ���ʽ������ÿĦ�����ᷴӦת��2Ħ�����ӣ�����0.5Ħ�����ᷴӦ��ת�Ƶ��ӵ����ʵ���Ϊ1Ħ�������������Ũ��Ϊcmol/l�����ݷ���ʽ�����б���Ϊ5:2=(c��10-3):(5��10-3��2��10-3)����c=2.5��10-3mol/L��
���㣺�����仯��������ʡ�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014-2015�ӱ�ʡ�����и߶���ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��N2(g)��3H2(g)  2NH3(g)��Ӧ�У���ʾ�÷�Ӧ����������
2NH3(g)��Ӧ�У���ʾ�÷�Ӧ����������
A��v��N2����0.1 mol����-1����-1 B��v��H2����0.9 mol����-1����-1
C��v��NH3����0.8 mol����-1����-1 D��v��N2����1 mol����-1��min-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015�㶫ʡտ���и߶���һѧ����ĩ��ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪��1.01��105Pa��298K�����£�2mol ������������ȼ������ˮ�����ų�484kJ�����������Ȼ�ѧ����ʽ��ȷ����
A��H2O(g) == H2(g) + 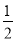 O2(g) ��H �� + 242kJ��mol-1
O2(g) ��H �� + 242kJ��mol-1
B��2H2(g) + O2(g) ==2H2O(l) ��H �� �� 484kJ��mol-1
C��H2(g) + 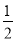 O2(g) ==H2O(g) ��H �� + 242kJ��mol-1
O2(g) ==H2O(g) ��H �� + 242kJ��mol-1
D��2H2(g) + O2(g) ==2H2O(g) ��H �� + 484kJ��mol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ��һ��ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
���и������������Ե�ˮ��Һ���ܴ����������
A��NH4+��Mg2����SO42����Cl�� B��Ba2����K����OH����NO3-
C��Al3����CH3COO����SO42����Cl�� D��Na����Ag����Cl����CO32-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ��һ��ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
���й���ʵ������ȡ������˵����ȷ����
A��ʢŨ����ķ�Һ©�����ó���©������
B��Ϊ�˱���ѧ���۲��������Ʊ�ʵ�飬���ڽ�̨��ֱ�����������Ʊ�ʵ��
C�����ñ���ʳ��ˮ����β��
D�����ڼ���ƿ�ڷ�һ��ʪ��ĵ��۵⻯����ֽ���۲������Ƿ��ռ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ�����з�һ�����У��һ��ѧ����ĩ��ѧ�Ծ��������棩 ���ͣ�ѡ����
��������װ0��1mol�����ƣ���������һЩС�ף�����ˮ�У���ȫ��Ӧ������ˮȡ�����ռ����������壬���ռ���������Ϊ����״����
A��O2��H2�Ļ������ B��1.12LH2
C������1.12LH2 D����1.12LH2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ�����з�һ�����У��һ��ѧ����ĩ��ѧ�Ծ��������棩 ���ͣ�ѡ����
NA��ʾ�����ӵ����������¸���������������������
A����״����11.2 L���� B��17g����
C��0.8mol���� D�����³�ѹ�£�36mL��H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ�����з�һ�����У�߶���ѧ����ĩ��ѧ�Ծ��������棩 ���ͣ�ѡ����
���л�ѧ��Ӧ��ʾ��ȷ����
A��Cl2ͨ��ˮ�У�Cl2+H2O=2H+ +Cl-+ClO-
B���ö��Ե缫��ⱥ��NaCl��Һ�� 2H++2Cl-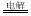 Cl2��+H2��
Cl2��+H2��
C����ʯī���缫���CuSO4��Һ��2Cu2++2H2O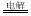 2Cu+O2��+4H+
2Cu+O2��+4H+
D����������������ʴʱ������ӦΪ��Fe - 3e- = Fe3+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015�����г�������һ��ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ������
��ͼΪ�����仯���������뻯�ϼ۶�Ӧ�Ĺ�ϵͼ��

��1��ʵ������ȡ������
�� ��ѧ����ʽ�� ��
�� ���������ſ������ռ�������ԭ���� ��
�� ��ˮ���ն���İ���ʱ���罫����ֱ�Ӳ���ˮ�У�
����������������������ԭ���� ��
��2���������������NO�Ļ�ѧ����ʽ��
�� ����NԪ�صĻ�ԭ�ԣ�
a. ����β���в�����NO��N2 + O2  2NO��
2NO��
b. ���Ĵ�������_________��
�� ����NԪ�ص������ԣ�_________��
��3��NO2 ������ˮ�������ΪV mL���Թܳ���NO2����ˮ�У�����ͼ��

�� NO2����ˮ�Ļ�ѧ����ʽ��_________��
�� ʹ�Թ���NO2��ȫ��ˮ���յIJ�����________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com