
镁、铝单质的化学性质以相似为主,但也存在某些重大差异性,下列物质能用于证明二者存在较大差异性的是 ( )
①CO2 ②盐酸 ③NaOH溶液 ④水
A.①④ B.②③ C.①③ D.②③④
科目:高中化学 来源: 题型:
下列有关说法正确的是
A.4CuO(s)=2Cu2O(s)+O2(g)在室温下不能自发进行,说明该反应△H>0
B.向稀醋酸中加入醋酸钠固体,溶液pH升高的主要原因是醋酸钠水解呈碱性
C.室温下K(HCN)<K(CH3COOH),说明CH3COOH的电离度一定比HCN大
D.H2S(g)+FeO(s)  FeS(s)+H2O(g),其他条件不变时增大压强,反应速率V正(H2S)和H2S的平衡转化率均增大
FeS(s)+H2O(g),其他条件不变时增大压强,反应速率V正(H2S)和H2S的平衡转化率均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
20.A、B、C、D四种短周期元素,A、B为同周期元素,B、C同主族,B、C可形成共价化合物BC3 和BC2,A、D同主族,A的原子结构示意图如下图,据此填空:
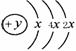 (1)A的元素名称为 。
(1)A的元素名称为 。
(2)A、B、C三种元素的原子,半径由小到大的顺序为 (用元素符号作答)。
(3)A、B和D最高价氧化物对应的水化物,酸性由强到弱的顺序为 (用对应酸的分子式作答,下同)。若用下图装置验证这三种酸的酸性强弱,则在装置中加入的试剂分别为:Ⅰ ,Ⅱ ,Ⅲ 。
观察到的实验现象为 。
写出Ⅲ中现象对应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
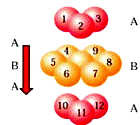
下列有关说法正确的是( )
A.锂、钛、铁分别位于周期表s、d、ds区
B.CaO的熔点为2614℃,属于原子晶体
C.金属铬采取体心立方堆积,则其堆积方式如右图
D.某元素的电负性为1.5 ,它是金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
工业废水中含有多种有害成分,任意排放将造成严重污染,进行分类处理达标后才能排放。
(1)含有Cu2+等离子的废水,常加入FeS等难溶物质作为沉淀剂除去。请用离子方程式说明上述除杂的原理 。实验室可利用FeS制取H2S,若将H2S通入足量NaOH溶液中,所得溶液中Na+与其他微粒的浓度关系是c(Na+)= 。
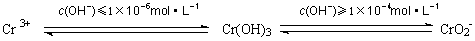 (2)含铬废水有毒,危害很大.处理方法是在含+6价铬的废水中加入一定量的硫酸和硫酸亚铁,使+6价铬还原成+3价铬;再调节溶液pH在6~8之间,使Fe3+和Cr3+转化为Fe(OH)3、Cr(OH)3沉淀而除去.用离子方程式表示溶液pH不能超过10的原因 。
(2)含铬废水有毒,危害很大.处理方法是在含+6价铬的废水中加入一定量的硫酸和硫酸亚铁,使+6价铬还原成+3价铬;再调节溶液pH在6~8之间,使Fe3+和Cr3+转化为Fe(OH)3、Cr(OH)3沉淀而除去.用离子方程式表示溶液pH不能超过10的原因 。
已知:
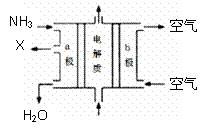 (3)废水中的氨可以回收再利用。
(3)废水中的氨可以回收再利用。
①氨能设计成如图所示的碱性燃料电池。产生的X气体可直接排放到大气中。a电极作 极,其电极反应式为
。
②加水稀释氨水的过程中,下列表达式的数值变大的是 。
A.c(H+) B.c(OH-)/c(NH3·H2O)
C.c(H+)·c(OH-) D.c(NH4+) +c(H+)
③T℃下, NH3·H2O的电离常数为Ka,NH4+的水解平衡常数为Kh,则该温度下水的离子积常数Kw= 。
④一定条件下,向某密闭容器中加入一定量的N2和H2发生可逆反应:
N2(g)+3H2(g) 2NH3(g)ΔH=-92.2 kJ·mol-1,测得0到10 s内,c(H2)减小了0.75 mol·L-1,下列说法正确的是( )
2NH3(g)ΔH=-92.2 kJ·mol-1,测得0到10 s内,c(H2)减小了0.75 mol·L-1,下列说法正确的是( )
A.该反应的逆反应的活化能不小于92.2 kJ·mol-1
B.10 s内氨气的平均反应速率为0.025 mol·L-1·s-1
C.10 s到15 s内c(NH3)增加量小于0.25 mol·L-1
D.达平衡后,分离出少量NH3,平衡向正反应方向移动,v正增大
查看答案和解析>>
科目:高中化学 来源: 题型:
粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物。进行如下实验:
①取适量A进行铝热反应,产物中有单质B生成;
②另取20 g A全部溶于0.15 L 6.0 mol·L-1盐酸中,得溶液C;
③将①中得到的单质B和溶液C反应,放出1.12 L(标况)气体,同时生成溶液D,还残留有固体物质B;
④用KSCN溶液检验时,溶液D不变色。
请填空:
(1)①中引发铝热反应的实验操作是________,产物中的单质B是________。
(2)②中所发生的各反应的化学方程式是_____________________________________
________________________________________________________________________。
(3)③中所发生的各反应的离子方程式是_____________________________________
________________________________________________________________________。
(4)若溶液D的体积仍视为0.15 L,则该溶液中c(Mg2+)为__________,c(Fe2+)为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
若甲、乙、丙三位同学用规定的药品制备Al(OH)3。规定必用的药品如下:350 g 70% H2SO4溶液,NaOH固体240 g,足量铝屑、水(不能用其他药品)。
甲、乙、丙用各自设计的方案制得Al(OH)3的质量分别是W1、W2、W3。三种实验方案如下:
甲:铝→加NaOH溶液→加H2SO4溶液→W1 g Al(OH)3
乙:铝→加H2SO4溶液→加NaOH溶液→W2 g Al(OH)3
丙: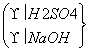 →W3 g Al(OH)3
→W3 g Al(OH)3
试回答:
(1)从充分利用原料、降 低成本和提高产率等因素分析,实验方案最合理的是________。
低成本和提高产率等因素分析,实验方案最合理的是________。
(2)三位学生制得的Al(OH)3,W1、W2、W3其质量由大到小的顺序是________________________________________________________________________。
(3)制得Al(OH)3的最大质量是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是 ( )
A.铝制容器可盛装热的浓硫酸
B.镁的金属性比 铝的金属性强
铝的金属性强
C.氢氧化铝能溶于过量氨水
D.镁在空气中燃烧生成的固体只有MgO
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定。
 (1)该实验应选用 作指示剂;
(1)该实验应选用 作指示剂;
(2)右图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的 刻度为25,滴定管中液面读数应为 mL;
(3)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为c mo1/L,三次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.35 | 25.30 |
从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,其原因可能是 。
A.实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗,
E.滴加NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(4)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不必化简):
C(CH3COOH)= mo1/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com