
| A. | 两种溶液中,由水电离出的氢离子浓度均为1×10-11 mol•L-1 | |
| B. | 分别加水稀释100倍后,两种溶液的pH仍相同 | |
| C. | 醋酸中的c(CH3COO-)和硫酸中的c(SO42-)相等 | |
| D. | 分别加入足量锌片,两种溶液生成H2的体积相同 |
分析 A、pH均为3的醋酸和硫酸,溶液中氢离子浓度为1×10-3mol/L,根据Kw=c(H+)•c(OH-)计算溶液中c(OH-),溶液中水电离出的氢离子浓度等于溶液中氢氧根离子的浓度;
B、硫酸是强电解质,完全电离,醋酸是弱电解质,加水稀释,醋酸继续电离出氢离子;
C、根据电荷可知,醋酸溶液中c(H+)=c(CH3COO-),硫酸溶液中c(H+)=2c(SO42-);
D、酸是强电解质,完全电离,醋酸是弱电解质,溶液中主要以醋酸分子存在,与足量的锌反应,醋酸提供的氢离子远远大于硫酸.
解答 解:A、pH均为3的醋酸和硫酸,溶液中氢离子浓度均为1×10-3mol/L,溶液中氢氧根浓度均为c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-3}}$=1×10-11mol/L,溶液中水电离出的氢离子浓度等于溶液中氢氧根离子的浓度,故两种溶液中,由水电离出的氢离子浓度均为1×10-11mol•L-1,故A正确;
B、硫酸是强电解质,完全电离,醋酸是弱电解质,加水稀释,醋酸继续电离出氢离子,分别加水稀释100倍后,硫酸溶液的pH值为5,醋酸溶液的pH值小于5,故B错误;
C、根据电荷可知,醋酸溶液中c(H+)=c(CH3COO-)=1×10-3mol/L,硫酸溶液中c(H+)=2c(SO42-)=1×10-3mol/L,故c(SO42-)=5×10-4mol/L,故C错误;
D、酸是强电解质,完全电离,醋酸是弱电解质,溶液中主要以醋酸分子存在,与足量的锌反应,醋酸提供的氢离子远远大于硫酸,锌与醋酸反应产生的氢气原大于与硫酸反应生成的氢气,故D错误;
故选A.
点评 本题考查弱电解质的电离、溶液pH的有关计算等,难度不大,注意弱电解质的电离存在平衡,电离程度很小.


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:选择题
| A. | KF的电子式: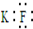 | |
| B. | 异丁烷的结构简式:CH3CH2CH2CH3 | |
| C. | 硫离子的结构示意图: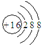 | |
| D. | 氢氧化钡的电离方程式:Ba(OH)2=Ba2++(OH-)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
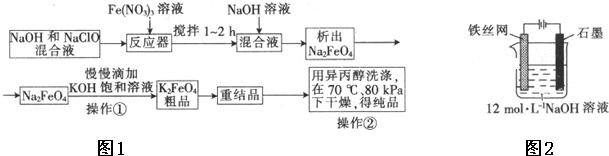
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
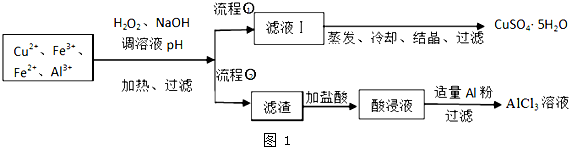
| 离子 | Fe3+ | Fe2+ | Al3+ | Cu2+ |
| pH范围 | 2.2~3.2 | 5.5~9.0 | 4.1~5.0 | 5.3~6.6 |
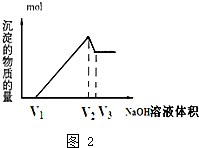
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 成份 | 浓度/(mol•L-1) | 质量分数 |
| HCl FeCl2 FeCl3 | -- 1.920 0.071 | 5.00% 8.94% 0.33% |
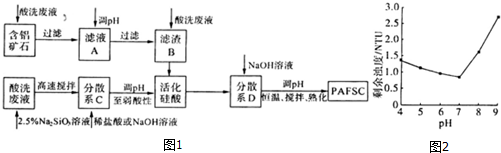
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ②③④⑤⑥ | C. | ④⑤⑥⑦ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  装置中阳极上析出红色固体 | |
| B. |  装置的待镀铁制品应与电源负极相连 | |
| C. |  装置中粗铜应与电源负极相连 | |
| D. | 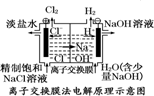 装置的离子交换膜允许阳离子、阴离子、水分子自由通过 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com