
| A. | 某溶液中加入NaOH溶液,生成蓝色沉淀,说明原溶液中含有Cu2+ | |
| B. | 某溶液中加入BaCl2溶液,生成白色沉淀,说明原溶液中含有SO42- | |
| C. | 某溶液中加入硝酸银溶液,生成白色沉淀,说明原溶液中含有Cl- | |
| D. | 某溶液中加入稀硫酸,产生无色气体,将气体通入澄清石灰水中生成白色沉淀,说明原溶液中含有CO32- |
分析 A.蓝色沉淀为氢氧化铜;
B.白色沉淀可能为AgCl;
C.白色沉淀可能为碳酸银;
D.无色气体可能为二氧化碳或二氧化硫,白色沉淀可能为碳酸钙或亚硫酸钙.
解答 解:A.蓝色沉淀为氢氧化铜,则说明原溶液中含有Cu2+,故A正确;
B.白色沉淀可能为AgCl,则检验硫酸根离子,应先加盐酸无现象,再加氯化钡生成白色沉淀,故B错误;
C.白色沉淀可能为碳酸银,则检验氯离子,应先加硝酸排除干扰离子,故C错误;
D.无色气体可能为二氧化碳或二氧化硫,白色沉淀可能为碳酸钙或亚硫酸钙,则原溶液可能含有CO32-或HCO3-,或含原溶液中含有SO32-等,故D错误;
故选A.
点评 本题考查物质的鉴别和检验,为高频考点,把握物质的性质、发生的反应及现象等为解答的关键,侧重分析与实验能力的考查,注意离子检验的试剂选择及排除干扰离子,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 析出的氢氧化钠的质量为大于$\frac{40a}{31}$g | |
| B. | 单位体积溶液中OH-个数不变 | |
| C. | 溶液中Na+数目减少 | |
| D. | 氧化钠与水反应生成了碱,所以溶质的质量分数变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
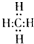 ,结构式是
,结构式是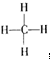 ,能说明它是正四面体而非正方形平面结构的理由是②.(填写编号)
,能说明它是正四面体而非正方形平面结构的理由是②.(填写编号)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{c({H}^{+})•c(N{H}_{3}•{H}_{2}O)}{c(N{H}_{4}^{+})}$ | B. | $\frac{c(N{H}_{4}^{+})•c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$ | ||
| C. | $\frac{c{H}^{+}}{cO{H}^{-}}$ | D. | c(H+)•c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一氧化碳的摩尔质量为28g | |
| B. | 0.5 mol OH-的质量为8.5g | |
| C. | 镁原子的摩尔质量等于它的相对原子质量 | |
| D. | 一个钠原子的质量等于$\frac{23}{6.02×1{0}^{23}}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烧杯中放入锌的质量比乙烧杯中放入锌的质量大 | |
| B. | 甲烧杯中的酸过量 | |
| C. | 两烧杯中参加反应的锌等量 | |
| D. | 反应开始后乙烧杯中的c(H+)始终比甲烧杯中的c(H+)小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
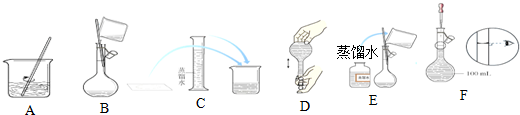
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com