
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:| 测定次数 | 待测液体积/mL | 标准盐酸体积/mL | |
| 滴定前读数/mL | 滴定后读数/mL | ||
| 第一次 | 25.00 | 0.40 | 20.38 |
| 第二次 | 25.00 | 4.00 | 24.02 |
分析 (1)根据滴定终点,锥形瓶中的溶液颜色发生变化,且30s内不恢复;
(2)根据待测溶液润洗锥形瓶,会使的待测液的物质的量增多;根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差;
(3)滴定管的刻度线自上而下逐渐增大,且读数到0.01ml;
(4)第一次酸的体积为20.38mL-0.40mL=19.98mL,第二次酸的体积为24.02mL-4.00mL=20.02mL,消耗酸的平均体积为20.00mL,利用H+、OH-的物质的量相等来计算.
解答 解:(1)用盐酸滴定氢氧化钠溶液以酚酞作指示剂,终点现象是当滴加最后一滴标准液时,溶液由红色变为无色,且30s不复色,
故答案为:当滴加最后一滴标准液时,溶液由红色变为无色,且30s不复色;
(2)根据待测溶液润洗锥形瓶,会使的待测液的物质的量增多,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$,可知c(标准)偏大;
故答案为:待测溶液润洗锥形瓶;偏高;
(3)滴定管的刻度线自上而下逐渐增大,且读数到0.01ml,所以关键滴定管中的液面可知,读数应该是22.60ml;
故答案为:22.60;
(4)第一次酸的体积为20.38mL-0.40mL=19.98mL,第二次酸的体积为24.02mL-4.00mL=20.02mL,消耗酸的平均体积为20.00mL,由酸碱中和的实质可知,20.00mL×0.1000mol•L-1=25.00mL×c(碱),解得c(碱)=0.08000mol•L-1;
故答案为:0.08000mol•L-1.
点评 本题考查酸碱中和滴定,明确中和滴定实验的原理、步骤、指示剂的选择、数据处理等即可解答,注意滴定管的读数为易错点,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
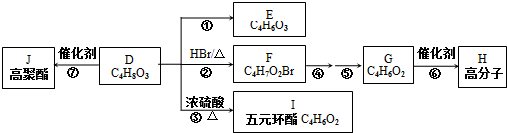
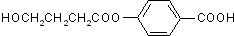 、I
、I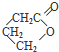 、J
、J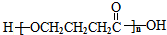 .
. .
. .
. 任意一种.
任意一种.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 碱金属元素的阳离子随核电荷数增加,氧化性渐弱而还原性渐强 | |
| B. | 碱金属元素的原子半径越大,越易失电子,其单质还原性越强 | |
| C. | 随核电荷数增多,碱金属单质的熔点一定渐低,密度一定渐大 | |
| D. | 碱金属单质的金属性强,均易与Cl2、O2、N2等发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴定前需要检查滴定管是否漏水 | |
| B. | 用对应加入的溶液润洗的仪器有:酸式滴定管、锥形瓶 | |
| C. | 滴定管(装标准溶液)在滴定前尖嘴处有气泡,滴定终了无气泡,会使滴定结果偏高 | |
| D. | 用已知浓度盐酸滴定未知浓度的NaOH溶液,终点读数时俯视滴定管的刻度,会造成计算值偏低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(H2)=0.8mol/(L•s) | B. | v(N2)=0.4mol/(L•s) | ||
| C. | v(NH3)=0.6mol/(L•s) | D. | v(H2)=4.2mol/(L•min) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com