


 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:
| A、向盛有苯酚溶液的试管中滴入FeCl3溶液,溶液呈紫色 |
| B、淀粉溶液遇碘离子变蓝 |
| C、氨气能使湿润的蓝色石蕊试纸变红 |
| D、二氧化硫能使石蕊溶液变红后褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 硫元素有多种化合价,可形成多种化合物.
硫元素有多种化合价,可形成多种化合物.| ① | ||
|
| ②加入足量氯水 |
| 同时加过量BaCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ① | ||||||||
| ② | ③ | ④ | ||||||
| ⑤ | ⑥ | ⑦ | ||||||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
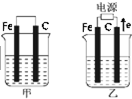 I.C2H6在氧气中完全燃烧生成二氧化碳和液态水,利用该反应设计一个燃料电池,用氢氧化钾溶液作电解质溶液,多孔石墨做电极,在电极上分别通入乙烷和氧气.通入乙烷气体的电极上发生的电极反应式是
I.C2H6在氧气中完全燃烧生成二氧化碳和液态水,利用该反应设计一个燃料电池,用氢氧化钾溶液作电解质溶液,多孔石墨做电极,在电极上分别通入乙烷和氧气.通入乙烷气体的电极上发生的电极反应式是查看答案和解析>>
科目:高中化学 来源: 题型:
 (Ⅰ)几种含硅元素的物质之间的相互转化关系如图所示.(注意:在溶液中观察到硅酸沉淀实际上是H4SiO4,H4SiO4在空气中易失水形成H2SiO3)试判断:
(Ⅰ)几种含硅元素的物质之间的相互转化关系如图所示.(注意:在溶液中观察到硅酸沉淀实际上是H4SiO4,H4SiO4在空气中易失水形成H2SiO3)试判断:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com