
| W | Y | |
| X | Z |
| A. | 若W的氧化物为WO2,则Z的最高价含氧酸一定为H2ZO4 | |
| B. | 若X的单质可作半导体材料,则Y的氢化物的水溶液一定显碱性 | |
| C. | 原子半径大小顺序一定为X>Z>Y>W | |
| D. | 最高正化合价大小顺序一定为Y=Z>X>W |
分析 A.若W的氧化物为WO2,W为C或N,Z为S或Cl;
B.X的单质可作半导体材料,X为Si,则Y为N;
C.电子层越多,原子半径越大,同周期从左向右原子半径减小;
D.Y可能为O、F,无正价.
解答 解:A.若W的氧化物为WO2,W为C或N,Z为S或Cl,若Z为Cl,Z的最高价含氧酸一定为HZO4,故A错误;
B.X的单质可作半导体材料,X为Si,则Y为N,则Y的氢化物为氨气,其水溶液一定显碱性,故B正确;
C.电子层越多,原子半径越大,同周期从左向右原子半径减小,则原子半径大小顺序一定为X>Z>W>Y,故C错误;
D.Y可能为O、F,无正价,最高正价为Z>X>W,故D错误;
故选B.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、元素的性质、元素化合物知识为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:推断题
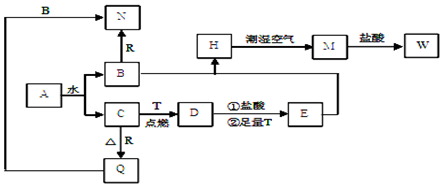

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径Y>Z>X | |
| B. | X分别与Y、Z形成的化合物均至少有两种 | |
| C. | 最高价氧化物对应水化物的酸性:W>Z | |
| D. | 氢元素在与X、Y、Z分别形成的化合物中,化合价均为+1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
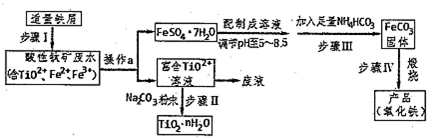
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
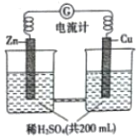 如图所示由锌片、铜片和稀H2SO4(密度为1.25g•cm-3)组成的原电池,一段时间后,若锌片只发生电化学反应,当在铜片上放出1.68L(标准状况下)气体时,H2SO4恰好梢耗一半,则原硫酸溶质的质量分数为( )
如图所示由锌片、铜片和稀H2SO4(密度为1.25g•cm-3)组成的原电池,一段时间后,若锌片只发生电化学反应,当在铜片上放出1.68L(标准状况下)气体时,H2SO4恰好梢耗一半,则原硫酸溶质的质量分数为( )| A. | 0.75% | B. | 2.94% | C. | 5.88% | D. | 11.76% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L0.1mol•L-1NaHS溶液中,S2-与HS-数目之和为0.1NA | |
| B. | 标准状况下,22.4LSO3含有NA个SO3分子 | |
| C. | 4gD2O与4gH218O含有的中子数均为2NA | |
| D. | 常温下,56g铁片投入足量浓H2SO4中生成NA个SO2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
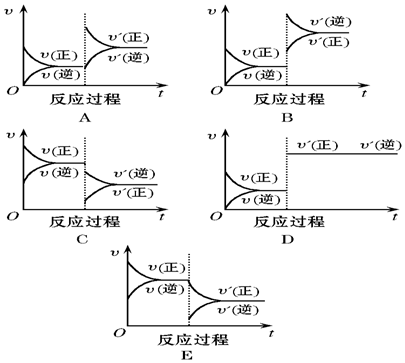
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.3 gNa+中含有NA个电子 | |
| B. | 硫酸的摩尔质量与硫酸分子的质量相等 | |
| C. | NA个CC14分子在标准状况下的体积约为22.4 L | |
| D. | 18 g H2O中含有NA个H2、NA个O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com