
以下是依据一定的分类标准,对某些物质与水反应情况进行分类的图示。
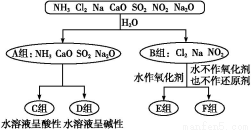
请根据你所学的知识,按要求填空:
(1)上述第一级分类标准(分成A、B组的依据)是 。
(2)F组中物质除了Cl2外还有 (填化学式)。
(3)A组中的CaO经常用作食品包装袋中的干燥剂,CaO所属的物质类型为 (用序号填空)。
①金属氧化物;②碱性氧化物;③碱;④碱性干燥剂
CaO可作干燥剂的理由是 (用化学方程式表示)。
(4)D组中NH3的水溶液呈弱碱性,用电离方程式表示其呈弱碱性的原因: 。
(5)由Al3+制备Al(OH)3,最好不选择D组中的NaOH溶液,说明理由: 。
(1)是否发生氧化还原反应 (2)NO2
(3)①②④ CaO+H2O Ca(OH)2
Ca(OH)2
(4)NH3·H2O N
N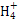 +OH-
+OH-
(5)过量NaOH溶液会溶解生成的Al(OH)3沉淀
【解析】(1)分析A、B两组物质与水的反应情况可知第一级分类标准是是否发生氧化还原反应。
(2)Cl2、NO2与水反应时,水既不作氧化剂也不作还原剂。
(3)CaO能与水反应,吸收水蒸气,故①②④正确。
(4)D组中NH3的水溶液呈弱碱性的原因是:NH3·H2O发生电离:NH3·H2O N
N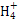 +OH-,产生OH-。
+OH-,产生OH-。
(5)由Al3+制备Al(OH)3,最好不选择NaOH溶液,因为过量NaOH溶液会溶解生成的Al(OH)3沉淀。


科目:高中化学 来源:2014高考化学专题突破训练 专题8电化学原理练习卷(解析版) 题型:选择题
如图是铅蓄电池充、放电时的工作示意图,已知放电时电池反应为:PbO2+Pb+4H++2S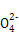 =2PbSO4+2H2O。下列有关说法正确的是( )
=2PbSO4+2H2O。下列有关说法正确的是( )
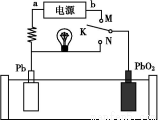
A.K与N相接时,能量由电能转化为化学能
B.K与N相接时,H+向负极区迁移
C.K与M相接时,阳极附近的pH逐渐增大
D.K与M连接时,所用电源的a极为负极
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题4化学反应中的能量变化练习卷(解析版) 题型:选择题
同温同压下,下列各组热化学方程式中,ΔH1<ΔH2的是( )
A.S(g)+O2(g)=SO2(g) ΔH1S(s)+O2(g)=SO2(g) ΔH2
B.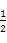 H2(g)+
H2(g)+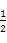 Cl2(g)=HCl(g) ΔH1H2(g)+Cl2(g)=2HCl(g) ΔH2
Cl2(g)=HCl(g) ΔH1H2(g)+Cl2(g)=2HCl(g) ΔH2
C.2H2(g)+O2(g)=2H2O(g) ΔH12H2(g)+O2(g)=2H2O(l) ΔH2
D.C(s)+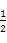 O2(g)=CO(g) ΔH1C(s)+O2(g)=CO2(g) ΔH2
O2(g)=CO(g) ΔH1C(s)+O2(g)=CO2(g) ΔH2
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题2化学常用计量 溶液练习卷(解析版) 题型:填空题
配制500 mL 0.5 mol/L的NaOH溶液,试回答下列问题:
(1)计算:需要NaOH固体的质量为 。
(2)配制方法:设计五个操作步骤。
①向盛有NaOH固体的烧杯中加入200 mL蒸馏水使其溶解,并冷却至室温;
②继续往容量瓶中加蒸馏水至液面接近刻度线1~2 cm;
③将NaOH溶液沿玻璃棒注入500 mL容量瓶中;
④用少量的蒸馏水洗涤烧杯和玻璃棒2~3次,然后将洗涤液移入容量瓶;
⑤改用胶头滴管加蒸馏水至刻度线,加盖摇匀。
试将操作步骤正确排序 。
(3)某学生实际配制NaOH溶液的浓度为0.48 mol/L,原因可能是 。
A.使用滤纸称量氢氧化钠固体
B.容量瓶中原来存在少量蒸馏水
C.溶解后的烧杯未经多次洗涤
D.胶头滴管加水定容时仰视刻度线
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题2化学常用计量 溶液练习卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.在1 L 0.1 mol/L硫化钠溶液中阴离子总数大于0.1NA
B.1 mol O2作氧化剂时转移电子数一定为4NA
C.标准状况下,22.4 L戊烷所含分子数为NA
D.在1 L 1.0 mol/L NaCl溶液中含有NA个NaCl分子
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题1物质的组成性质分类和化学用语练习卷(解析版) 题型:选择题
下列物质分类正确的是( )
①混合物:铝热剂、福尔马林、水玻璃、漂白粉 ②化合物:氯化钙、烧碱、冰水混合物、胆矾 ③电解质:明矾、二氧化碳、冰醋酸、硫酸钡 ④同系物:CH2O2、C2H4O2、C3H6O2、C4H8O2 ⑤同素异形体:C60、C70、金刚石、石墨
A.①②④ B.②③④ C.①②⑤ D.②④⑤
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题14有机化学基础选修5练习卷(解析版) 题型:填空题
利胆解痉药“亮菌甲素”跟(CH3)2SO4反应可以生成A,两者的结构简式如图。
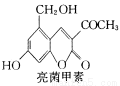

试回答下列有关问题:
(1)“亮菌甲素”的分子式为 ;1 mol“亮菌甲素”跟浓溴水反应时最多消耗 mol Br2。
(2)有机物A能发生如下转化。其中G分子中的碳原子在一条直线上。

已知:(1)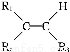

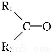 +
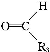
+
(2)R—O—CH3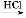 R—OH(R为脂肪烃或芳香烃的烃基)
R—OH(R为脂肪烃或芳香烃的烃基)
①C→D中①的化学方程式是 ;
②G的结构简式是 ;
③符合下列条件的E的同分异构体有 种:
a.遇FeCl3溶液显色;
b.不能发生水解反应,能发生银镜反应;
c.苯环上的一氯取代物只有一种,分子中无甲基
写出其中至少2种的结构简式: 。
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题12化学实验基本操作与方案设计练习卷(解析版) 题型:实验题
草酸亚铁(FeC2O4·2H2O)用作分析试剂及显影剂和新型电池材料磷酸亚铁锂的生产。已知:CO能与氯化钯(PdCl2)溶液反应生成黑色的钯粉。回答下列问题:
Ⅰ:兴趣小组对草酸亚铁的分解产物进行实验和探究。
(1)将气体产物依次通过A、澄清石灰水,B、氯化钯,观察到A中澄清石灰水变浑浊,B中有黑色物质生成,则上述现象说明气体产物中有 。
(2)探究分解得到的固体产物中铁元素的存在形式。
①提出假设
假设1: ; 假设2:FeO; 假设3:FeO和Fe的混合物。
②设计实验方案证明假设3。
限选试剂:1.0 mol·L-1盐酸、3% H2O2溶液、0.1 mol·L-1CuSO4溶液、20% KSCN溶液、蒸馏水。
实验步骤 | 现象与结论 |
步骤1:向试管中加入少量固体产物,再加入足量 ,充分振荡 | 若溶液颜色明显改变,且有 生成,则证明有铁单质存在 |
步骤2:将步骤1中得到的浊液过滤,并用蒸馏水洗涤至洗涤液无色 |
|
步骤3:取步骤2得到的少量固体于试管中,滴加 |
|
Ⅱ:某草酸亚铁样品中含有少量草酸。现用滴定法测定该样品中FeC2O4的含量。滴定反应是:5Fe2+ +5C2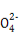 +3Mn
+3Mn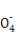 +24H+
+24H+ 5Fe3+ +10CO2↑+3Mn2++12H2O实验方案设计为:
5Fe3+ +10CO2↑+3Mn2++12H2O实验方案设计为:
①将准确称量的0.20 g草酸亚铁样品置于250 mL锥形瓶内,加入适量2 mol/L的H2SO4溶液,使样品溶解,加热至70 ℃左右,立即用浓度为0.020 00 mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为V1 mL。
②向上述滴定混合液中加入适量的Zn粉和过量的2 mol/L的H2SO4溶液,煮沸5~8 min,用KSCN溶液在点滴板上检验点滴液,直至溶液不立刻变红。将滤液过滤至另一个锥形瓶中,继续用0.020 00 mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为V2 mL。
③重复以上实验1~2次。
若某小组的一次测定数据记录如下:V1= 18.90 mL,V2=6.20 mL。根据数据计算0.20 g 样品中:n(Fe2+)= ; n(C2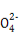 )= ;FeC2O4 的质量分数为 (精确到0.01%)。
)= ;FeC2O4 的质量分数为 (精确到0.01%)。
查看答案和解析>>
科目:高中化学 来源:2014江苏省扬州市届高三上学期期末考试化学试卷(解析版) 题型:选择题
向甲、乙两恒温恒容的密闭容器中,分别充入一定量的A和B,发生反应:A(g)+B(g) 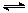 xC(g) △H<0。测得两容器中c(A)随时间t的变化如图所示:
xC(g) △H<0。测得两容器中c(A)随时间t的变化如图所示:

容器 | 甲 | 乙 |
容积(L) | 0.5 | 0.5 |
反应放热(kJ) | Q1 | Q2 |
反应物起始量 | 1 molA 1 molB | 0.5 molA 0.5 molB |
下列说法正确的是
A.x=1
B.Q1>2Q2
C.根据题中信息无法计算a值
D.保持其他条件不变,起始时向乙容器充入0.2 mol A、0.2 mol B、0.2 mol C,则此时v(正)> v(逆)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com