
| A. | 金属钠存放于煤油中 | |
| B. | NaOH溶液盛放在带橡皮塞的试剂瓶中 | |
| C. | 新制的氯水保存在棕色玻璃试剂瓶中 | |
| D. | 漂白粉露置在空气中保存 |
分析 A.钠能与空气中的水和氧气反应,又钠的密度比水略小;
B.氢氧化钠呈强碱性,能和二氧化硅反应生成硅酸钠,硅酸钠具有黏性,能把玻璃塞黏住;
C.氯水见光会分解;
D.漂白粉中的次氯酸钙能与空气中的二氧化碳反应,故漂白粉需密闭保存.
解答 解:A.钠能与空气中的水和氧气反应,又钠的密度比水略小,故钠保存在煤油中,或用石蜡密封保存,故A正确;
B.氢氧化钠与玻璃中二氧化硅反应,生成具有黏性的硅酸钠,导致玻璃塞打不开,应用橡胶塞,故B正确;
C.氯水见光会分解,应盛放在棕色瓶中,故C正确;
D.漂白粉中的次氯酸钙能与空气中的二氧化碳反应,生成碳酸钙和次氯酸,次氯酸见光易分解,从而使漂白粉失效,故漂白粉需密闭保存,故D错误,
故选D.
点评 本题考查了化学试剂的存放,题目难度不大,需要掌握常见试剂的保存方法,关键是掌握试剂的性质,关键化学性质选择保存方法,试题基础性强,侧重对学生灵活运用基础知识解决实际问题的能力的培养.


科目:高中化学 来源: 题型:解答题
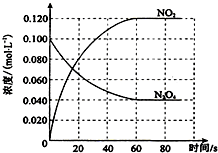 在容积为100L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,混合气体的颜色变深.
在容积为100L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,混合气体的颜色变深.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钙(CaO2)的电子式: | |
| B. | 某微粒的结构示意简图为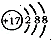 ,则该元素在周期表中位于第三周期、VIA族 ,则该元素在周期表中位于第三周期、VIA族 | |
| C. | H2CO3的电离方程式:H2CO3?2H++CO32- | |
| D. | 葡萄糖的结构简式:C6H12O6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3水解:CO32-+2H2O?H2CO3+2OH- | |
| B. | 用惰性电极电解饱和NaCl溶液:2Cl-+2H2O $\frac{\underline{\;电解\;}}{\;}$ Cl2↑+H2↑+2OH- | |
| C. | FeBr2溶液中通入足量的Cl2:2Fe2++Cl2=2Fe3++2Cl- | |
| D. | 等体积等物质的量浓度的Ca(HCO3)2与NaOH溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,22.4L 氢气含有氢分子个数为NA | |
| B. | 标准状况下,11.2 L 水含有水分子个数为0.5NA | |
| C. | 1L 0.3mol•L-1Na2SO4 溶液中,含有Na+和SO42- 总数为0.6NA | |
| D. | 18g水含有电子数为10NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com