
【题目】重铬酸钾是一种常见的强氧化剂.实验室以精选铬铁矿(主要成分可表示为FeOCr2O3 , 还含有SiO2、Al2O3等杂质)为原料制备重铬酸钾晶体(KCr2O7 , 式量294)的流程如下: 
请回答下列问题:
(1)操作1中发生的反应有:4FeOCr2O3+8Na2CO3+7O2 ![]() 8Na2CrO4+2Fe2O3+8CO2↑
8Na2CrO4+2Fe2O3+8CO2↑
Na2CO3+Al2O3 ![]() 2NaAlO2+CO2↑
2NaAlO2+CO2↑
Na2CO3+SiO2 ![]() Na2SiO3+CO2↑
Na2SiO3+CO2↑
该步骤在常温下的反应速度较慢,为使反应速率增大,可采取的两条措施是 .
(2)固体Y中主要含有 . (填写化学式)
(3)酸化步骤使含铬物质发生了转化,请写出离子反应方程式 .
(4)操作4中的化学反应在溶液中能发生的可能理由是;获得K2Cr2O7晶体的操作依次是:加入KCl固体,在水浴上加热浓缩至 , 冷却结晶,抽滤,洗涤,干燥.
(5)通过下列实验可测定产品中重铬酸钾的质量分数:
称取重铬酸钾试样1.470g,用100mL容量瓶配制成溶液.移取25.00mL溶液于碘量瓶中,加入适里稀硫酸和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min.然后加入一定量的水,加入淀粉指示剂,用0.1500mol/L标准溶液滴定,共消耗标准浓36.00mL.滴定时发生的反应的离子方程式为:I2+2S2O32﹣=2I﹣+S4O62﹣
则所测产品中重铬酸钾的纯度为
(6)有关上述实验过程中涉及的部分实验操作的描述,正确的是
A.粗产品若要进一步提纯,可以采用重结晶的方法
B.配制溶液时,用托盘夭平称取试样后,一般经溶解、转移(含洗涤)、定容等步骤,配制成100mL溶液
C.滴定时,当最后一滴标准溶液滴入时,溶液变为蓝色,且半分钟内不变色,可判断滴定终点
D.滴定终点时俯视读数,测定结果偏低.
【答案】
(1)升高温度、将原料粉碎(或使用催化剂)
(2)Al(OH)3、H2SiO3
(3)2CrO42﹣+2H+=Cr2O72﹣+H2O
(4)该条件下,K2Cr2O7的溶解度较小;溶液表面出现晶膜(或溶液中析出固体)
(5)72%
(6)AD
【解析】解:(1)操作1中为使反应速率增大,可采取的两条措施是升高温度、将原料粉碎(或使用催化剂),所以答案是:升高温度、将原料粉碎(或使用催化剂);(2)根据上面的分析可知,固体Y的成份为Al(OH)3、H2SiO3 ,
所以答案是:Al(OH)3、H2SiO3;(3)结合流程图可知,酸化为了转化CrO42﹣离子为Cr2O72﹣ , 反应的离子方程式为2CrO42﹣+2H+=Cr2O72﹣+H2O,
所以答案是:2CrO42﹣+2H+=Cr2O72﹣+H2O;(4)操作4是向含Cr2O72﹣的溶液中加入氯化钾,生成溶解度极小的K2Cr2O7 , 所以该反应在溶液中能发生的可能理由是在该条件下,K2Cr2O7的溶解度较小,从K2Cr2O7溶液中获得晶体,要将溶液蒸发浓缩到有少量晶体析出再冷却结晶,
所以答案是:该条件下,K2Cr2O7的溶解度较小;溶液表面出现晶膜(或溶液中析出固体);(5)根据实验步骤可知,用碘化钾Cr2O72﹣将还原成Cr3+ , 根据电子得失守恒有关系式Cr2O72﹣~3I2 , 再用Na2S2O3标准溶液滴定( I2+2S2O32﹣═2I﹣+S4O62﹣),所以有关系式Cr2O72﹣~3I2~6S2O32﹣ , Na2S2O3的物质的量为0.1500mol/L×36.00mL=5.4×10﹣3 mol,所以样品中K2Cr2O7的物质的量 ![]() ×5.4×10﹣3 mol×
×5.4×10﹣3 mol× ![]() =3.6×10﹣3 mol,样品中K2Cr2O7的纯度为
=3.6×10﹣3 mol,样品中K2Cr2O7的纯度为 ![]() ×100%=72%,
×100%=72%,
所以答案是:72%;(6)A.粗产品中可能含有氯化钠杂质,所以若要进一步提纯,可以用重结晶的方法,故A正确;
B.配制溶液时,用托盘夭平称取试样后,一般经溶解、转移(含洗涤)、定容、摇匀等步骤,配制成100mL溶液,故B错误;
C.滴定时,用Na2S2O3滴定I2 , 滴定终点时溶液由蓝色变为无色,故C错误;
D.滴定终点时俯视读数,测定结果偏低,读取的标准液体积偏小,所以测得的结果偏低,故D正确,
故选AD.


 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:
【题目】常温下,向20.0mL 0.10molL﹣1的NaOH溶液中逐滴加入0.10molL﹣1的醋酸溶液,溶液pH随醋酸溶液体积的变化如图所示.下列说法正确的是( ) 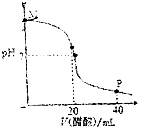
A.N点处恰好完全反应,c(CH3COO﹣)=c(CH3COOH)
B.O点处显中性,c(CH3COO﹣)=c(Na+)=c(H+)=c(OH﹣)
C.M点到O点过程中,可能出现c(CH3COO﹣)>c(Na+)
D.P点处显酸性,c(CH3COO﹣)+c(CH3COOH)=2c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.H2、D2和T2互称为同位素,它们的化学性质几乎—样
B.二氧化碳、盐酸、氨水分别属于非电解质、强电解质、弱电解质
C.胶体和其它分散系的本质区别是丁达尔效应
D.硅是一种良好的半导体材料,可以制成计算机芯片和硅太阳能电池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意解答
(1)将锌片和银片用导线相连浸入稀硫酸中组成原电池.若该电池中两电极的总质量为60g,工作一段时间后,取出锌片和银片洗净干澡后称重,总质量为47g,试计算产生氢气的体积(标准状况) .
(2)利用下列反应:Fe+2Fe3+=3Fe2+ , 设计一个化学电池(给出若干导线和一个小灯泡,电极材料和电解液自选):负极电极反应;正极材料 , 正极电极反应 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.含有羟基的有机物称为醇
B.能发生银镜反应的有机物都是醛
C.苯酚俗称石炭酸,酸性比碳酸强
D.C3H6和C4H8不一定是同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.某有机物燃烧只生成CO2和H2O,且二者物质的量相等,则此有机物的组成为CnH2n
B.一种烃在足量的氧气中燃烧并通过碱石灰,减少的体积就是生成水蒸气的体积
C.某气态烃CxHy与足量O2恰好完全反应,如果反应前后气体体积不变(温度>100℃),则y=4,若体积减少,则y>4,否则y<4
D.相同质量的烃,完全燃烧,消耗的O2越多,则烃中氢元素的百分含量越高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外活动小组通过实验研究NO2的性质. 已知:2NO2+2NaOH═NaNO3+NaNO2+H2O
利用图1所示装置探究NO2能否被NH3还原(K1、K2为止水夹,夹持固定装置略去)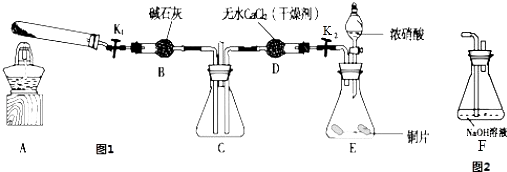
(1)该实验中制取氨气时若只用一种试剂,从下列物质中选取 a.NH4HCO3 b.NH4Cl c.浓氨水
(2)若NO2能够被NH3还原,预期观察到C装置中的现象是 .
(3)此实验装置存在一个明显的缺陷是 .
(4)探究NO2能否与Na2O2发生氧化还原反应.为了验证NO2能被Na2O2氧化,该小组同学选用B、D、E装置,将B中的药品更换为Na2O2 , 另选F装置(如图2所示),重新组装,进行实验,装置的合理连接顺序是
(5)实验过程中,B装置中淡黄色粉末逐渐变成白色.经检验该白色物质为纯净物,且无其他物质生成.推测B装置中反应的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=﹣99kJmol﹣1 . 请回答下列问题: 图中A表示 , E的大小对该反应的反应热(填“有”或“无”)影响.该反应通常用V2O5作催化剂,加V2O5会使图中B点(填“升高”还是“降低”),△H(填“变大”、“变小”或“不变”).图中△H=kJmol﹣1 . 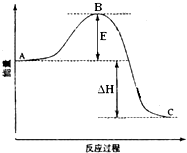
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com