
����Ŀ������ˮ��ɽ���ǽ�ɽ��ɽ���ѳ�Ϊ���صı��ơ�
��1�����Ṥҵ�ų���β������Ҫ��SO2���ж��ִ�����ʽ
�����������п����������Ṥҵβ������___
a������Na2SO3��Һ b������NaCl��Һ c��ϡH2SO4 d��Ũ��ˮ
�����Ṥҵ�ų���β��Ҳ�������̿���Ҫ�ɷ�ΪMnO2�����գ�����MnSO4��д����Ӧ�Ļ�ѧ����ʽ___��
��2����������β����NO��CO�ķ���֮һ������������������װһ����ת��װ�ã�ʹNO��CO�ڴ���������ת��Ϊ�����ʡ�д���÷�Ӧ�Ļ�ѧ����ʽ��___��
��3����NaOH��Һ��������շ����еĵ��������ѧ����ʽ����NO+NO2+2NaOH=2NaNO2+H2O��2NO2+2NaOH=NaNO2+NaNO3+H2O
����������Ӧ�зֱ����ĵ�����NO2ʱ��ת�Ƶ��ӵ����ʵ���֮��Ϊ___��
�ڱ�״����5.6L������壨ֻ��NO��NO2����0.5molL��1NaOH��Һ��ȫ���գ�������ҪNaOH��Һ�����Ϊ___L��
���𰸡�d SO2+MnO2=MnSO4 2CO+2NO![]() 2CO2+N2 2��1 0.5
2CO2+N2 2��1 0.5
��������
��1���٣����Ṥҵβ����Ҫ�ɷ�Ϊ�����������������Ϊ����������ݴ˷���ѡ��������Һ��
�ڣ��������̺Ͷ�������Ӧ���������̣�
��2��ʹNO��CO�ڴ���������ת��Ϊ������Ϊ������̼�͵�����
��3���٣�![]() ��Ӧ������1mol������������ת��1mol���ӣ�2NO2+2NaOH��NaNO2+NaNO3+H2O��Ӧ������1mol��������������ת��1mol���ӣ�
��Ӧ������1mol������������ת��1mol���ӣ�2NO2+2NaOH��NaNO2+NaNO3+H2O��Ӧ������1mol��������������ת��1mol���ӣ�
�ڣ���״����5.6L�������(ֻ��NO ��NO2)���ʵ���=![]() =0.25mol���� 0.5molL��1NaOH��Һ��ȫ���գ��������Σ����Ԫ���غ����������ҪNaOH��Һ�������
=0.25mol���� 0.5molL��1NaOH��Һ��ȫ���գ��������Σ����Ԫ���غ����������ҪNaOH��Һ�������
��1����a������Na2SO3��Һ���ն��������٣���a����
b������NaCl��Һ�������ն�����������Ϊ���ն�������������Լ�����b����
c��ϡH2SO4�������ն�����������Ϊ���ն�������������Լ�����c����
d��������ˮ����β����������Ӧ������������狀�ˮ���ù�����ˮ����β�������ӷ���ʽΪ��SO2+2NH3H2O��2NH4++SO32��+H2O����d��ȷ��
�ʴ�Ϊ��d��
�ڣ�β��Ҳ�������̿�MnO2�����գ��������̺Ͷ�������Ӧ���������̣�ͼ1��ʾ����Ӧ1���Ļ�ѧ����ʽΪ��SO2+MnO2��MnSO4���ʴ�Ϊ��SO2+MnO2��MnSO4��
��2����������β����NO��CO�ķ���֮һ������������������װһ����ת��װ�ã�ʹNO��CO�ڴ���������ת��Ϊ������Ϊ�����Ͷ�����̼����Ӧ�Ļ�ѧ����ʽΪ��2CO+2NO![]() 2CO2+N2���ʴ�Ϊ��2CO+2NO
2CO2+N2���ʴ�Ϊ��2CO+2NO![]() 2CO2+N2��
2CO2+N2��
��3���٣�NO+NO2+2 NaOH��2NaNO2+H 2O����Ӧ������1mol������������ת��1mol���ӣ�2NO2+2NaOH��NaNO2+NaNO3+H2O����Ӧ������2mol��������������ת��
1mol������Ӧ�зֱ����ĵ�����NO2ʱ��ת�Ƶ��ӵ����ʵ���֮�ȣ�2��1���ʴ�Ϊ��2��1��
�ڣ���״����5.6L������壨ֻ��NO��NO2�����ʵ�����![]() ��0.25mol����0.5molL��1NaOH��Һ��ȫ���գ��������Σ�Na��N��1:1�����Ԫ���غ���㣬�����������ʵ���Ϊ0.25mol��������ҪNaOH��Һ�����V��
��0.25mol����0.5molL��1NaOH��Һ��ȫ���գ��������Σ�Na��N��1:1�����Ԫ���غ���㣬�����������ʵ���Ϊ0.25mol��������ҪNaOH��Һ�����V��![]() ��0.5L���ʴ�Ϊ��0.5��
��0.5L���ʴ�Ϊ��0.5��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. ǿ���ǿ��ķ�Ӧ��һ�����к���
B. 1molC��ȫȼ�շ���383.3kJ�����Ȼ�ѧ����Ϊ��C+O2=CO2��H=��383��3kJ��mol��1
C. ��ϡ��Һ�У��������кͷ�Ӧ����1 mol H2Oʱ�ķ�Ӧ�Ƚ����к���
D. ��ʾ�к��ȵ����ӷ���ʽΪ��H+��aq��+OH����aq��![]() H2O��l������H=57��3KJ��mol��1
H2O��l������H=57��3KJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)����˫��ˮ��������̿�(��Ҫ�ɷ���MnO2)�Ľ����ʣ���ת����Mn2+��д������������˫��ˮ������̿�����ʵ����ӷ���ʽ��_________��
(2)�����������Ʒ�Ӧ���������к���IO3-��д����Ӧ���̵����ӷ���ʽ��___��
(3) ��������е�Cr2O3������Na2CO3�ڿ����б��գ�Cr2O3������ΪNa2CrO4������CO2�ݳ���д���÷�Ӧ�Ļ�ѧ����ʽ��_____________��
(4)ij����С����ʵ�����ý�Ũ��KOH��Һֱ�������������о����ַ�Ӧ����һ��ʱ���ʼ����KClO3�������࣬����KClO3�����ӷ���ʽ��_______��
(5) ����ȱλ����ͭ(CuFe2O4��x)������������̫�����Ȼ�ѧѭ���ֽ�H2OҲ����H2��������ת����ͼ1��ʾ��
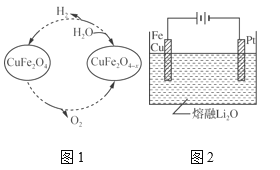
����ȱλ����ͭ(CuFe2O4��x)��ˮ��Ӧ�Ļ�ѧ����ʽΪ_________��
��CuFe2O4���õ绯ѧ�����õ�����ԭ����ͼ2��ʾ���������ĵ缫��ӦʽΪ_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ˮ��ɽ���ǽ�ɽ��ɽ�����������ҹ������ƽ���ɫ��չ��ѭ����չ�ȣ��γɽ�Լ��Դ�ͻ��������Ŀռ��֡�
��.Ϊ��Ѱ��Ի�������Ⱦȼ��ȼ�շ����������о����ڱ������µ�����������̼������������õĻ�����
��1��ȷ���÷�Ӧ�ķ�Ӧ�������£�
��һ����NO2(g)+CO(g)��O��N��O��C��O��O ��H=+134kJ/mol
�ڶ�����O��N��O��C��O��NO(g)+CO2(g) ��H=-368kJ/mol
�ܷ�Ӧʽ��NO2(g)+CO(g)��NO(g)+CO2(g) ��H=___kJ/mol
��2����������һ����ѧ��Ӧ��ͨ��ʵ�����ȷ���䷴Ӧ�����뷴Ӧ��Ũ�ȵĶ�����ϵ����=kcm(NO2)��cn(CO)���÷��̳�Ϊ���ʷ��̣�����k��Ϊ���ʳ����������������ݣ�д���÷�Ӧ�����ʷ��̱���ʽ��___��

II.����̿Ҳ�ɴ���������Ⱦ��NO����ԭ����2NO(g)+C(s)![]() CO2(g)+N2(g) ��H>0����T��ʱ�����ݻ�һ���ĸ��������м���NO����ͻ���̿�ۣ�ʹ֮������Ӧ��ø����ʵ����ʵ������£�
CO2(g)+N2(g) ��H>0����T��ʱ�����ݻ�һ���ĸ��������м���NO����ͻ���̿�ۣ�ʹ֮������Ӧ��ø����ʵ����ʵ������£�
![]()
��3������T��ʱ���÷�Ӧ��ƽ�ⳣ��K=___��
��4��Ϊ�����NO��ת���ʺͷ�Ӧ���ʣ��ɲ�ȡ�Ĵ�ʩ��___������ĸ����
A.����NO������ B.���ӻ���̿������
C.�����¶� D.������ϵѹǿ
��.�ü�ӵ绯ѧ���ɶԴ�����Ⱦ��NO���������������乤��ԭ����ͼ��ʾ��

��5���缫I�缫��ӦʽΪ___��
��6�����ʱH+���ƶ�����___�������������������������������������ƶ�����
��7������£�ÿ����1molNO��ͬʱ���ɲ���O2�����___L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ʰ������������[(H2NCH2COO)2Fe]��һ�����͵���Ӫ��ǿ�������㷺����ȱ����ƶѪ��Ԥ�������ơ�ijѧϰС��ģ����ϳɷ�����ͼ��
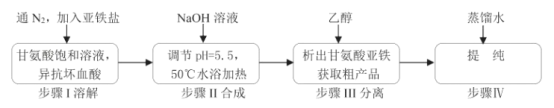
��֪��

��ش�
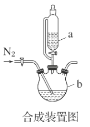
��1���ϳ�װ��������b��������___��
��2���ϳɹ����У���ʵ��Ϊ�˷�ֹFe2+����������ȡ�Ĵ�ʩ��___��
��3��д��ˮԡ���ȹ��������ɸʰ����������������ӷ���ʽ___��
��4������˵����ȷ����___��
A.����Һ��ǰ��Ӧ�ȴ�Һ©��a���Ͽڲ�����
B.��������������Ϣ��������Ӧѡ��FeSO4��7H2O
C.������еķ��뷽���ǹ���
D.����IV���ᴿ�����еĸ���������ѡ����ո���
��5���ϳɹ��������pH=5.5����˵������___��
��6������������ˮ�Ҵ���Ŀ����___��
��7�����ʰ����Ͷ����Ϊ300kg���õ���Ʒ344.8kg�����Ʒ�IJ���Ϊ___ %������һλС������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ӧ��L(s)��aG(g)![]() bR(g)�ﵽƽ��ʱ���¶Ⱥ�ѹǿ�Ը÷�Ӧ��Ӱ����ͼ��ʾ��ͼ��ѹǿp1��p2��x���ʾ�¶ȣ�y���ʾƽ��������G������������ݴ˿��жϣ� ��
bR(g)�ﵽƽ��ʱ���¶Ⱥ�ѹǿ�Ը÷�Ӧ��Ӱ����ͼ��ʾ��ͼ��ѹǿp1��p2��x���ʾ�¶ȣ�y���ʾƽ��������G������������ݴ˿��жϣ� ��
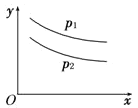
A. ������Ӧ�Ƿ��ȷ�ӦB. ������Ӧ�����ȷ�Ӧ
C. a+1��bD. a+1��b
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��pAg��-lgc(Ag+)��pX��-lg c(Xn-)��298Kʱ���������ʵ�Ksp���±���
��ѧʽ | AgCl | AgSCN | Ag2CrO4 |
��ɫ | �� | dz�� | �� |
Ksp | 1.8��1010 | 1.0��1012 | 2.0��1012 |
AgCl��AgSCN��Ag2CrO4�ı�����Һ�У������Ӻ������ӵ�Ũ�ȹ�ϵ��ͼ��ʾ������˵����ȷ����
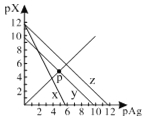
A.ͼ��x����AgCl���ߣ�z����AgSCN����
B.298Kʱ����Cl����CrO42�������ʵ���Ũ�Ⱦ�Ϊ0.1mol/L����Һ�У���������0.1mol/L��AgNO3��Һ�����Ȳ������Ǻ�ɫ����
C.298Kʱ������p���������Ũ�ȣ���y�ϵĵ������������ƶ�
D.298KʱAg2CrO4(s)��2SCN��(aq) ![]() 2AgSCN(s)��CrO42- (aq)��ƽ�ⳣ��K��2.0��1012
2AgSCN(s)��CrO42- (aq)��ƽ�ⳣ��K��2.0��1012
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�����о�������Ʒ�ĸ�ʴ��װ�õ����������ã��ҿ�ʼʱU�ι����˵ĺ�īˮҺ����ƽ��һ��ʱ����ܹ۲쵽�������⡣����˵������ȷ���ǣ� ��
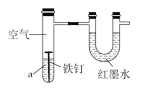
A. �������淢���ķ�ӦΪFe��3e-=Fe3+
B. ��Һ��aΪϡ���ᣬ��U�ι�Һ���Ҹ����
C. ��Һ��aΪʳ��ˮ����U�ι�Һ������ҵ�
D. ��Һ��aΪʳ���ͣ��������������ʽ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
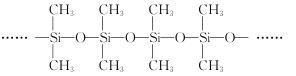
����Ŀ��SiC��ά������ǿ��TixAly�����ϲ��Ͽ���Ϊ�߳����ٷ���������ķ��Ȳ��ϡ��ش��������⣺
��1��CԪ�����������У���һ����������Ԫ����__(��Ԫ�ط���)���縺��������__(��Ԫ�ط���)��
��2����̬Tiԭ�ӵļ۵����Ų�ʽΪ__��������ߵ��ܼ���__���չ����
��3�������ͽṹ��ͼ��ʾ������Siԭ�ӵ��ӻ���ʽΪ__���Լ�����Ϊ��Ҫ�ɷֵĹ����ܹ����µ�ԭ����__��
��4��Li2CO3��Li2TiO3������ӵ���еij��ò��ϣ�����CO32-�Ŀռ乹��Ϊ__���京�еĹ��ۼ�������__��
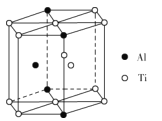
��5��TixAly�Ͻ��һ�ֽṹ��Ԫ��ͼ��ʾ(Al��Tiԭ�Ӹ���һ��ԭ���ڽṹ��Ԫ�ڲ�)���úϽ�Ļ�ѧʽΪ__����ṹ��Ԫ�ⳤΪapm������߳�Ϊbpm���úϽ���ܶ�Ϊ___g��cm-3��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com