
| A、c(OH-)=c(Na+)>c(HCOO-)>c(H+) |
| B、c(Na+)=c(HCOO-) |
| C、c(Na+)>c(HCOO-)>c(OH-)>c(H+) |
| D、c(H+)>c(HCOO-)>c(Na+)>c(OH-) |


科目:高中化学 来源: 题型:
| A、0.1mol?L-1 CH3COONa溶液中:c(CH3COO-)+c(CH3COOH)=0.1mol?L-1 |
| B、浓度均为0.1 mol?L-1 Na2CO3溶液和稀盐酸等体积混合后的溶液中:c(CO32-)+c(OH-)=c(H+)+c(H2CO3) |
| C、25℃时,pH=9.4、浓度均为0.1 mol?L-1的HCN与NaCN的混合溶液中:c(Na+)>c(CN-)>c(HCN)>c(OH-) |
| D、3.0L 0.1mol?L-1 NaOH溶液中缓慢通入CO2至溶液增重8.8 g时,溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
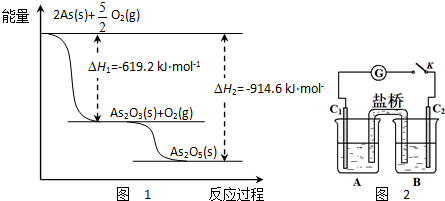
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
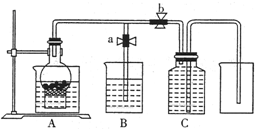 某同学设计如图所示装置来试验用粗铁粒与某浓度稀硝酸反应制取NO气体.
某同学设计如图所示装置来试验用粗铁粒与某浓度稀硝酸反应制取NO气体.
|
最终溶液中的阳离子及其物质的量 | ||||
<
|
|||||
=
|
a mol Fe3+ | ||||
大于
|
|||||
=
|
a mol Fe2+ | ||||
>
|
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、用此法提取镁的优点之一是原料来源丰富 |
| B、步骤⑦电解MgCl2时阴极产生氯气 |
| C、步骤⑥可将晶体置于HCl气氛中脱水 |
| D、上述工艺流程中涉及化合、分解和复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
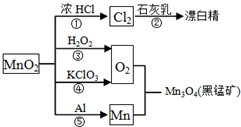
| A、反应①②③④⑤均属于氧化反应和离子反应 |
| B、反应⑤说明该条件下铝的还原性强于锰 |
| C、相同条件下生成等量的O2,反应③和④转移的电子数之比为1:1 |
| D、反应①中氧化剂与还原剂的物质的量之比为1:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
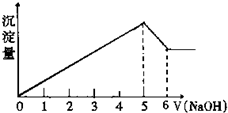 有一镁、铝合金,在适量稀硫酸中恰好完全溶解,再加入氢氧化钠溶液,析出沉淀的物质的量随氢氧化钠溶液的体积变化如图所示,则合金中镁、铝的物质的量之比为( )
有一镁、铝合金,在适量稀硫酸中恰好完全溶解,再加入氢氧化钠溶液,析出沉淀的物质的量随氢氧化钠溶液的体积变化如图所示,则合金中镁、铝的物质的量之比为( )| A、2:1 | B、4:1 |
| C、1:1 | D、1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验仪器(省略夹持装置) | 相应实验 |
| A | 烧杯、玻璃棒、酒精灯 | 溶液的浓缩结晶 |
| B | 蒸馏烧瓶、冷凝管、酒精灯 | 由工业酒精制无水酒精 |
| C | 天平、玻璃棒、胶头滴管、容量瓶 | 配制0.5mol?L-1的溶液100mL |
| D | 烧杯、玻璃棒、胶头滴管、分液漏斗 | 用溴水和CCl4除去NaBr溶液中的少量NaI |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氨水中通入过量SO2:SO2+NH3?H2O═NH4++HSO3- | ||||
| B、(CH3COO)2Ba溶液中加入稀硫酸:Ba2++SO42-═BaSO4↓ | ||||
C、用铜作电极电解CuSO4溶液:2Cu2++2H2O
| ||||
| D、Al2(SO4)3溶液中加入足量Ba(OH)2溶液:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com