
| A. | 反应①中电能转化为化学能 | |
| B. | 反应②为放热反应 | |
| C. | 反应③使用催化剂,△H3减小 | |
| D. | 反应CH4(g)═C(s)+2 H2(g)的△H=74.8kJ•mol-1 |
分析 A、太阳光催化分解水制氢气,是光能转化为化学能;
B、△H2>0,反应为吸热反应;
C、催化剂不能改变反应热的大小;
D、根据盖斯定律,目标反应CH4(g)═C(s)+2 H2(g)相当于③-②.
解答 解:A、太阳光催化分解水制氢气,是光能转化为化学能,故A错误;
B、反应的△H2>0,故该反应为吸热反应,故B错误;
C、催化剂不能改变反应热的大小,只能改变化学反应速率,故C错误;
D、根据盖斯定律,目标反应CH4(g)═C(s)+2 H2(g)相当于③-②,故△H=△H3-△H2,△H=206.1kJ•mol-1-131.3kJ•mol-1=74.8kJ•mol-1,故D正确.
故选D.
点评 本题考查了化学反应与能量变化,利用盖斯定律进行相关计算,注意催化剂不能改变焓变,盖斯定律计算时焓变的加减时正负号为易错点,题目难度较小.


科目:高中化学 来源: 题型:选择题
| A. | 放电时,Li+在电解质中由负极向正极迁移 | |
| B. | 放电时,负极的电极反应式为LixC6-xe-═xLi++C6 | |
| C. | 充电时,若转移1mol e-,石墨(C6)电极将增重7x g | |
| D. | 充电时,阳极的电极反应式为LiCoO2-xe-═Li1-xCoO2+xLi+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
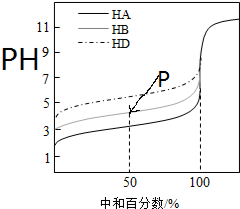 下列判断错误的是( )
下列判断错误的是( )| A. | 三种酸的电离常数关系:KHA>KHB>KHD | |
| B. | 滴定至P点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-) | |
| C. | pH=7时,三种溶液中:c(A-)=c(B-)=c(D-) | |
| D. | 当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有碳元素的化合物不一定是烃 | |
| B. | 正丁烷分子中四个碳原子可能在同一直线上 | |
| C. | 常温常压下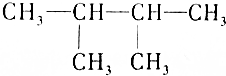 呈气态 呈气态 | |
| D. | 烷烃在任何情况下均不与强酸、强碱、氧化剂反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中子数为10的氧原子:${\;}_8^{10}O$ | B. | Mg2+的结构示意图: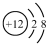 | ||
| C. | 硫化钠的电子式: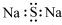 | D. | 甲酸甲酯的结构简式:C2H4O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳可与氢气在一定条件下转化为CO、CH3OH、CH3OCH3、HCOOH以及各种低碳烃,这些措施符合低碳经济的发展要求 | |
| B. | 石油分馏、海水晒盐、燃煤烟气的脱硫、菜籽中提取菜籽油等过程都是物理变化 | |
| C. | 利用电解原理可制备Na、Mg、Al等活泼金属,也可实现N2和H2合成NH3 | |
| D. | 研究发现出土的青铜器表面若有白色的CuCl,会加快青铜器的腐蚀速率,这是因为CuCl作为催化剂降低了腐蚀反应的活化能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中可能大量存在Al3+、NH4+、Cl?、H+ | |
| B. | 酸性溶液中可能大量存在Na+、ClO?、SO42?、I? | |
| C. | 碱性溶液中可能大量存在Na+、K+、Cl?、HCO3? | |
| D. | 中性溶液中可能大量存在Fe3+、K+、Cl?、I? |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
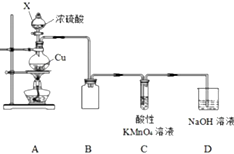 某化学兴趣小组探究铜与浓硫酸的反应,探究过程如下.
某化学兴趣小组探究铜与浓硫酸的反应,探究过程如下.| 实验步骤 | 现象 | 结论 |
| 取灰色固体于烧杯中,加入蒸馏水,搅拌、过滤,洗涤滤渣 | 固体部分溶解,溶液呈蓝色 | 灰色固体中含有CuSO4 |
| 将滤渣转移到另一烧杯中,加入足量稀硫酸,搅拌,充分反应后过滤,将滤渣洗涤、干燥 | 固体部分溶解,滤液呈蓝色,滤渣为黑色 | 灰色固体中含有CuO |
| 称量上一步得到的黑色滤渣2.56g,在空气中灼烧至恒重,冷却、称量 | 得到2.40g固体 | 灰色固体中含有Cu2S、CuS |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com