
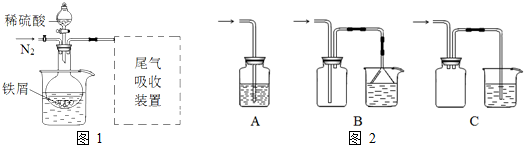
| ||
| ||
| 0.00169mol×278g/mol |
| 0.5g |


科目:高中化学 来源: 题型:
| A、Q=Q1+Q2+Q3 | ||
| B、Q=Q1-Q2-Q3 | ||
C、Q=
| ||
D、Q=
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,14 g由N2与CO组成的混合气体含有的原子数目为NA |
| B、78 g苯含有C=C双键的数目为3 NA |
| C、1 L 1 mol?L-1的NaClO溶液中含有ClO-的数目为NA |
| D、标准状况下,6.72 L NO2与水充分反应转移的电子数目为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
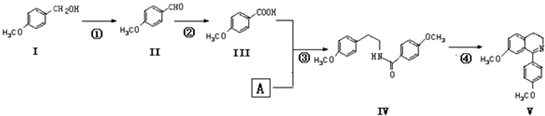
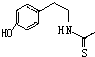 )在一定条件下也能发生类似上述第④步骤的环化反应,化合物Ⅶ环化反应产物的结构简式为
)在一定条件下也能发生类似上述第④步骤的环化反应,化合物Ⅶ环化反应产物的结构简式为查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 甲 | 乙 | 丙 | 丁 | 戊 |
| 化合价 | -4 | -1 | +1 | -4 | -2 |
| A、丙的常见氧化物有两种 |
| B、气态氢化物稳定性:丁>戊 |
| C、丁的氧化物能与乙的氢化物的水溶液反应 |
| D、原子半径大小:丙<丁 |
查看答案和解析>>
科目:高中化学 来源: 题型:
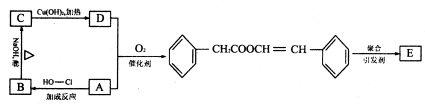
查看答案和解析>>
科目:高中化学 来源: 题型:
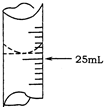 欲测定某NaOH溶液的物质的量浓度,可用0.1000mol?L-1HCl标准溶液进行中和滴定(用酚酞作指示剂).
欲测定某NaOH溶液的物质的量浓度,可用0.1000mol?L-1HCl标准溶液进行中和滴定(用酚酞作指示剂).| 实验序号 | 待测NaOH溶液的体积/mL | 0.1000mol?L-1HCl溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 26.11 |
| 2 | 25.00 | 1.56 | 31.30 |
| 3 | 25.00 | 0.22 | 26.31 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、碘化铵的电子式: |
B、间二甲苯的结构简式: |
| C、中子数为146、质子数为92的铀(U)原子:23892U |
D、氯原子的结构示意图: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com