
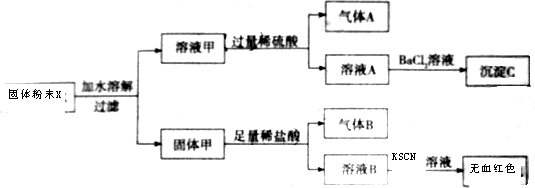
分析 K2SO3、K2CO3溶于水,且可都与稀硫酸反应生成气体,则K2SO3、K2CO3至少一种,气体A可能为SO2或CO2,加入硫酸钡生成沉淀C为硫酸钡,Fe、Fe2O3不溶于水,加入盐酸生成气体,则一定含有Fe,气体B为氢气,溶液B滴加KSN无血红色,说明不含铁离子,但不能说明不含Fe2O3,因Fe与铁离子反应生成亚铁离子,以此解答该题.
解答 解:K2SO3、K2CO3溶于水,且可都与稀硫酸反应生成气体,则K2SO3、K2CO3至少一种,气体A可能为SO2或CO2,加入硫酸钡生成沉淀C为硫酸钡,Fe、Fe2O3不溶于水,加入盐酸生成气体,则一定含有Fe,气体B为氢气,溶液B滴加KSN无血红色,说明不含铁离子,但不能说明不含Fe2O3,因Fe与铁离子反应生成亚铁离子,
(1)由以上分析可知,K2SO3、K2CO3至少一种,一定存在Fe,可能含有Fe2O3,故答案为:无;
(2)沉淀C为硫酸钡,化学式为BaSO4,故答案为:BaSO4;
(3)固体甲与稀盐酸反应生成气体B的离子方程式为Fe+2H+=Fe2++H2↑,故答案为:Fe+2H+=Fe2++H2↑.
点评 本题考查物质的检验和鉴别的实验方案的设计以及无机物的推断,侧重于元素化合物知识的综合运用,题目难度中等,注意把握反应的现象,根据现象结合物质的性质进行判断,注意体会.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| 共价键 | N-N | N-H | O=O | N≡N |
| 键能kJ•mol-1 | 3a | 2.5a | 4a | 8a |
| A. | 2a kJ•mol-1 | B. | 2.5a kJ•mol-1 | C. | 3a kJ•mol-1 | D. | 3.5a kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水 | B. | 脂肪类物质 | C. | 淀粉类物质 | D. | 蛋白质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12.5% | B. | 25% | C. | <25% | D. | >25% |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18gC含有9NA个电子 | |
| B. | 标准状况下22.4LCCl4含有4NA个氯原子 | |
| C. | 标准状况下,33.6LN2和H2的混合气体中含3NA个原子 | |
| D. | 2.709×1024个原子的水分子含有1.5NA个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
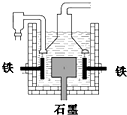 早在1807年化学家戴维用电解熔融氢氧化钠制得钠:
早在1807年化学家戴维用电解熔融氢氧化钠制得钠:| A. | 电解熔融氢氧化钠制钠,阳极发生电极反应为:2OH--2e-═H2↑+O2↑ | |
| B. | 盖•吕萨克法制钠原理是利用铁的还原性比钠强 | |
| C. | 若戴维法与盖•吕萨克法制得等量的钠,则两反应中转移的电子总数不相同 | |
| D. | 目前工业上常用电解熔融氯化钠法制钠(如上图),电解槽中石墨极为阳极,铁为阴极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com