
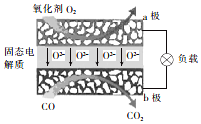
 为体现节能减排的理念,中国研制出了新型固态氧化物燃料电池(SOFC),该电池的丁作原理如图所示.下列说法正确的是( )
为体现节能减排的理念,中国研制出了新型固态氧化物燃料电池(SOFC),该电池的丁作原理如图所示.下列说法正确的是( )| A. | 电子从b极经导线流向a极 | |
| B. | 正极的电极反应式为O2+4e-+2H2O═4OH- | |
| C. | 还可以选用NaOH固体作固态电解质 | |
| D. | 若反应中转移1 mol电子,则生成22.4L(标准状况)CO2 |
分析 该燃料电池中,CO是燃料,所以CO失电子发生氧化反应,则CO所在的b电极为负极,通入氧气的a电极是正极,正极上氧气得电子发生还原反应,电子从负极沿外电路流向正极,据此分析解答.
解答 解:A.外电路中,电子从负极b极经导线流向正极a极,故A正确;
B.通入氧气的a电极是正极,正极上氧气得电子发生还原反应,电极反应式为O2+4e-═2O2-,故B错误;
C.因为NaOH与CO2会发生反应,所以不可以选用NaOH固体作固态电解质,故C错误;
D.CO所在的b电极为负极,电极反应式为CO-2e-+O2-=CO2,所以反应中转移1 mol电子,则生成0.5mol×22.4L/mol=11.2L(标准状况)CO2,故D错误;
故选A.
点评 本题考查了化学电源新型电池,明确原电池原理是解本题关键,难点是电极反应式的书写,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 稳定性:NH3<PH3<SiH4 | B. | 酸性:HClO4>H2SO4>H3PO4 | ||
| C. | 碱性:KOH>NaOH>Mg(OH)2 | D. | 氧化性:F2>Cl2>Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 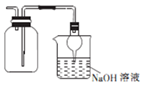 收集NO2并防止其污染环境 | |
| B. | 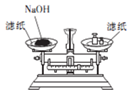 称取一定量的NaOH | |
| C. | 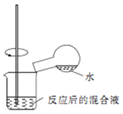 检验浓硫酸与铜反应后的产物中,是否含有铜离子 | |
| D. | 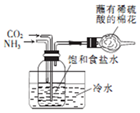 制取NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 LH2O中含有极性键的数目为2NA | |
| B. | 78 g Na2O2中含有的阴离子数为NA | |
| C. | 11 g重水(D218O)中含有的电子数力5NA | |
| D. | 常温常压下,5.6 g铁粉在7.1 g氯气中充分燃烧,转移的电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 13C的质量数是13,核外有6个电子 | |
| B. | 13C 与12C是两种不同的核素 | |
| C. | 13C 与12C互为同位素 | |
| D. | 13C 与12C 的化学性质有很大的差别 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaH在水中显碱性 | |
| B. | NaH中氢元素的离子的电子层排布与氖原子的电子层排布相同 | |
| C. | 微粒半径H-<Li+ | |
| D. | NaH与H2O反应时,水作还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
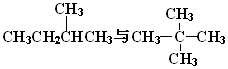 G.
G.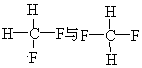
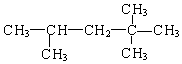 ,它是汽油燃烧品质抗震性能的参照物,其中A的同分异构体中含氢原子种类最少的一种结构简式为:
,它是汽油燃烧品质抗震性能的参照物,其中A的同分异构体中含氢原子种类最少的一种结构简式为: ;若A是由烯烃和H2通过加成反应得到,写出该烯烃的所有可能的结构简式
;若A是由烯烃和H2通过加成反应得到,写出该烯烃的所有可能的结构简式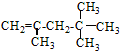 、
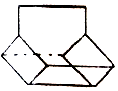
、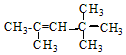 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HA是强酸 | |
| B. | 混合液中,c(HA)+c(A-)=0.4mol•L-1 | |
| C. | 混合液中,c(Na+)+c(H+)=$\frac{Ka(HA)•c(HA)+Kw}{c({H}^{+})}$ | |
| D. | 向混合液中加入蒸馏水,c(A-)与c(HA)的比值将增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com