
| 编号 | 纯净物 | 混合物 | 碱性氧化物 | 非电解质 |
| A | 液氯 | 漂白粉 | Al2O3 | CO |
| B | 冰醋酸 | 浓硫酸 | Na2O2 | 乙醇 |
| C | 碱石灰 | 王水 | K2O | Cl2 |
| D | 胆矾 | 水玻璃 | CaO | SO2 |
| A. | A | B. | B | C. | C | D. | D |
分析 纯净物是同种物质组成的,分为单质和化合物;混合物是不同物质组成;碱性氧化物是指和酸反应生成盐和水的氧化物,发生的是复分解反应;非电解质是在水溶液和熔融状态下都不导电的化合物;
A.氧化铝是两性氧化物;
B.过氧化钠是过氧化物,不是碱性氧化物;
C.碱石灰是氢氧化钠和氧化钙的混合物,氯气是单质不是非电解质;
D.胆矾为化合物,水玻璃是硅酸钠的水溶液,氧化钙是碱性氧化物,二氧化硫属于非电解质;
解答 解:A.液氯是液态氯气,是同种物质组成的纯净物,漂白粉是氯化钙和次氯酸钙的混合物,氧化铝和酸、碱反应生成盐和水属于两性氧化物,一氧化碳本身不能电离出离子属于非电解质,故A错误;
B.冰醋酸是一种物质组成的纯净物,浓硫酸是硫酸的水溶液属于混合物,过氧化钠和酸反应生成盐、水和氧气,不是碱性氧化物,乙醇不能电离属于非电解质,故B错误;
C.碱石灰是不同物质组成的混合物,王水是浓盐酸和浓硝酸的混合溶液属于混合物,氧化钾与酸反应生成盐和水属于碱性氧化物,氯气是单质不属于非电解质,故C错误;
D.胆矾是硫酸铜晶体为一种物质组成的纯净物,水玻璃是硅酸钠的水溶液属于混合物,氧化钙和酸反应生成盐和水是碱性氧化物,二氧化硫本身不能电离出离子属于非电解,故D正确;
故选D.
点评 本题考查了化合物、混合物、电解质、非电解质、碱性氧化物概念的应用判断,熟悉物质的组成,理解概念的含义是解题关键,题目较简单.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Fe3+、Cl-、ClO- | B. | Na+、K+、Ba2+、HCO3- | ||
| C. | Mg2+、NH4+、SO42-、Cl- | D. | Na+、K+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (b-a)/4 kJ•mol-1 | B. | (b-a+1.4c)/4 kJ•mol-1 | ||
| C. | (b-a+5.6c)/4 kJ•mol-1 | D. | b-a+1.4c kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学键 | C-H | C-C | C═C | H-H |
| 键能/kJ•mol-1 | 412 | 348 | 612 | 436 |
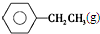 $\stackrel{催化剂}{?}$
$\stackrel{催化剂}{?}$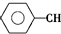 ≡CH2(g)+H2(g)的反应热△H为( )
≡CH2(g)+H2(g)的反应热△H为( )| A. | -124 kJ/mol | B. | +124 kJ/mol | C. | -40 kJ/mol | D. | +40 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去Fe3+中Al3+:加入过量氨水充分反应后,过滤 | |
| B. | 除去FeCl3 中少量CuCl2:用足量的铁粉,过滤 | |
| C. | 除去石英中的碳酸钙:用足量稀盐酸溶解后,过滤 | |
| D. | 除去铝粉中的镁粉:加入足量的氢氧化钠溶液后,过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 亚氯酸钠是一种高效氧化型漂白剂,主要用于棉纺、亚麻、纸浆等漂白.亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是毒性很大的气体.经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出).在25℃时,下列分析正确的是( )
亚氯酸钠是一种高效氧化型漂白剂,主要用于棉纺、亚麻、纸浆等漂白.亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是毒性很大的气体.经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出).在25℃时,下列分析正确的是( )| A. | 使用该漂白剂的最佳pH为3 | |
| B. | pH=5时,溶液中$\frac{c(Cl{{O}_{2}}^{-})}{c(HCl{O}_{2})}$=$\frac{1}{10}$ | |
| C. | pH=6时,NaClO2溶液中:c(Na+)+c( H+)=c( ClO2-)+c( OH-) | |
| D. | NaClO2溶液加水稀释所有离子浓度均减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca(ClO)2不稳定,易分解 | |
| B. | Ca(ClO)2与空气中的水和二氧化碳反应 | |
| C. | CaCl2易吸水而潮解 | |
| D. | Ca(ClO)2与CaCl2相互反应,生成无漂白作用的物质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com