
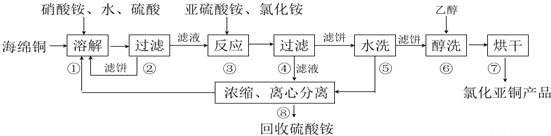
分析 酸性条件下硝酸根离子具有氧化性,可氧化海绵铜(主要成分是Cu和少量CuO)生成硫酸铜,过滤后在滤液中加入亚硫酸铵发生氧化还原反应生成CuCl,发生2Cu2++SO32-+2Cl-+H2O=2CuCl+SO42-+2H+,得到的CuCl经硫酸酸洗,水洗后再用乙醇洗涤,可快速除去固体表面的水分,防止水解、氧化,步骤②、④、⑤、⑧都要进行固液分离,根据混合的水溶性进行分离,没有发生化学变化,可用离心机以及框式压滤机,以得到滤饼,氯化亚铜与氯化铁发生Fe3++CuCl═Fe2++Cu2++Cl-,加入K2Cr2O7溶液,发生6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,结合关系式解答该题.
解答 解:酸性条件下硝酸根离子具有氧化性,可氧化海绵铜(主要成分是Cu和少量CuO)生成硫酸铜,过滤后在滤液中加入亚硫酸铵发生氧化还原反应生成CuCl,发生2Cu2++SO32-+2Cl-+H2O=2CuCl+SO42-+2H+,得到的CuCl经硫酸酸洗,水洗后再用乙醇洗涤,烘干得到氯化亚铜.
(1)由于酸性条件下硝酸根离子具有氧化性,可氧化Cu生成CuSO4或Cu2+,溶解温度应控制在60-70℃,原因是温度低溶解速度慢,温度过高铵盐分解,硝酸铵在酸性环境下有氧化性,能氧化铜,生成铜离子,
故答案为:温度低溶解速度慢,温度过高铵盐分解;在酸性环境下有氧化性;
(2)铜离子与亚硫酸铵发生氧化还原反应生成CuCl,发生2Cu2++SO32-+2Cl-+H2O=2CuCl+SO42-+2H+,
故答案为:2Cu2++SO32-+2Cl-+H2O=2CuCl+SO42-+2H+;
(3)由流程可知,经酸洗、水洗后得到硫酸铵,则应加入硫酸,为防止CuCl溶解,不能加入硝酸等氧化性酸,也不能加入盐酸,防止引入新杂质,
故答案为:硫酸;
(4)步骤⑥为醇洗,因乙醇沸点低,易挥发,则用乙醇洗涤,可快速除去固体表面的水分,防止水解、氧化,
故答案为:醇洗有利于加快去除CuCl表面水分防止其水解氧化;
(5)氯化亚铜与氯化铁发生Fe3++CuCl═Fe2++Cu2++Cl-,加入K2Cr2O7溶液,发生6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,
反应的关系式为6CuCl~6Fe2+~Cr2O72-,
6 1
n ab×10-3mol
n=6ab×10-3mol,
m(CuCl)=99.5g/mol×6ab×10-3mol=0.597abg,
则样品中CuCl的质量分数为$\frac{0.597ab}{m}$×100%,
故答案为:$\frac{0.597ab}{m}$×100%.
点评 本题考查学生阅读获取信息的能力、常用化学用语、氧化还原滴定的应用等,侧重于学生的分析能力、实验能力和计算能力的考查,注意把握物质的性质以及反应流程,难度中等,注意(5)中利用关系式的计算.


科目:高中化学 来源: 题型:解答题
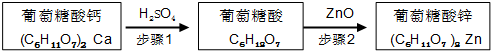
| 物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
| 水中的溶解性 | 可溶于冷水 易溶于热水 | 可溶 | 易溶 | 易溶 |
| 乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |
 请回答下列问题:
请回答下列问题:
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用乙烷和氯气等物质的量混合可以得到纯净的氯乙烷 | |
| B. | 将稀硫酸和无水酒精按3:1的体积比混合加热到170℃制取乙烯 | |
| C. | 将电石和饱和食盐水置于启普发生器中制取乙炔 | |
| D. | 用酸性KMnO4溶液可将己烷和己烯二种无色液体鉴别开来 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
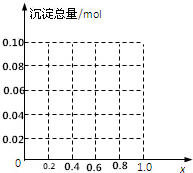 现有AlCl3和FeCl3混合溶液,其中Al3+和Fe3+的物质的量之和为0.1mol,在此溶液中加入90mL浓度为4mol/L的NaOH溶液,使其充分反应,设Al3+的物质的量与总物质的量的比值为x.
现有AlCl3和FeCl3混合溶液,其中Al3+和Fe3+的物质的量之和为0.1mol,在此溶液中加入90mL浓度为4mol/L的NaOH溶液,使其充分反应,设Al3+的物质的量与总物质的量的比值为x.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学反应方程式 | 平衡常数 | |
| 500℃ | 700℃ | |
| ①2H2(g)+CO(g)=CH3OH(g)△H1=akJ/mol | 2.5 | 0.2 |
| ②H2(g)+CO2(g)=CO(g)+H2O(g)△H2=bkJ/mol | 1.0 | 2.3 |
| ③3H2(g)+CO2(g)=CH3OH(g)+H2O(g)△H3 | K3 | 4.6 |
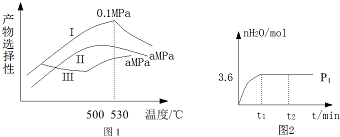
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .若元素X的原子最外层电子排布式为nsn-1npn+1,那么X的元素符号为S,原子的价电子排布图为
.若元素X的原子最外层电子排布式为nsn-1npn+1,那么X的元素符号为S,原子的价电子排布图为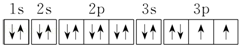 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com