

| 消耗量 |
| 起始量 |
| 生成物浓度系数幂次方 |
| 反应物浓度系数幂次方 |
| [CO]?[H2] |
| [H2O] |
| [CO]?[H2] |
| [H2O] |
| 消耗量 |
| 起始量 |
| 0.5mol |
| 1mol |
| 1.5×0.5 |
| 0.5×2.5 |


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
 转变成
转变成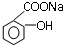 的方法是( )
的方法是( )| A、加入足量的NaOH(aq)并加热 |
| B、与足量NaOH(aq)共热后,通入足量CO2 |
| C、与盐酸共热后,加入足量的NaOH(aq) |
| D、与稀硫酸共热后,加入足量Na2CO3 (aq) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、K+、SO42-、NO3-、Cl- |
| B、Fe2+、H+、Br-、NO3-、Cl- |
| C、Ca2+、K+、OH-、Cl-、NO3- |
| D、Al3+、Na+、Cl-、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向苏打和小苏打溶液中分别加入足量稀盐酸 | 均冒气泡 | 两者均能与盐酸反应 |
| B | 向AgNO3溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3?H2O能大量共存 |
| C | 把SO2通入紫色石蕊试液中 | 紫色褪去 | SO2具有漂白性 |
| D | 将水蒸气通过灼热的铁粉,将生产的气体通入肥皂液中,点燃肥皂泡 | 产生爆鸣声 | 铁与水在高温下发生反应 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | CO | H2 | |||
| ① | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
| ② | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
| ③ | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:
 随着尖端技术的发展,氟的用途日益广泛,如用F2将UF4氧化成UF6,然后用气体扩散法使铀的同位素235U和238U分离.而氟单质的制备通常采用电解氧化法.如图是电解熔融的氟氢化钾(KHF2)和无水氟化氢的混合物的实验装置:
随着尖端技术的发展,氟的用途日益广泛,如用F2将UF4氧化成UF6,然后用气体扩散法使铀的同位素235U和238U分离.而氟单质的制备通常采用电解氧化法.如图是电解熔融的氟氢化钾(KHF2)和无水氟化氢的混合物的实验装置:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电镀时,通常把待镀的金属制品作阳极 |
B、如图Zn为负极,发生还原反应 |
| C、如图电子由Zn电极流向Cu电极,盐桥中的Cl-移向CuSO4溶液 |
| D、氢氧燃料电池(酸性电解质)中O2通入正极,电极反应为:O2+4H++4e-=2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CuCl2(CuCl2) |
| B、AgNO3(AgNO3) |
| C、NaCl (NaCl) |
| D、CuSO4[Cu(OH)2] |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com