
分析 M是石油裂解的主要产品之一,M的气体密度是相同条件下H2的14倍,则相对分子质量为28,应为CH2=CH2,在一定条件下与水反应得到A,则A为C2H5OH,化合物X是一种具有浓郁香味的有机物,X在酸性条件下水解得到A和B,可知X为酯类化合物,水解生成醇和酸,A和B分子中含有相同的碳原子数,则B为CH3COOH,X为CH3COOC2H5,以此解答该题.
解答 解:M是石油裂解的主要产品之一,M的气体密度是相同条件下H2的14倍,则相对分子质量为28,应为CH2=CH2,在一定条件下与水反应得到A,则A为C2H5OH,化合物X是一种具有浓郁香味的有机物,X在酸性条件下水解得到A和B,可知X为酯类化合物,水解生成醇和酸,A和B分子中含有相同的碳原子数,则B为CH3COOH,X为CH3COOC2H5,
(1)①由以上分析可知M为CH2=CH2,故答案为:CH2=CH2;
②B为CH3COOH,含有的官能团为-COOH,为羧基,故答案为:羧基;
(2)乙酸乙酯在酸性条件下水解生成乙酸和乙醇,方程式为CH3COOC2H5+H2O$?_{△}^{浓硫酸}$CH3COOH+C2H5OH,
故答案为:CH3COOC2H5+H2O$?_{△}^{浓硫酸}$CH3COOH+C2H5OH;
(3)A为乙醇,在催化条件下反应生成乙醛,乙醛与氧气进一步反应可生成乙酸,方程式为2CH3CH2OH+O2 $→_{△}^{Cu}$2CH3CHO+2H2O、2CH3CHO+O2 $\stackrel{催化剂}{→}$ 2CH3COOH,
故答案为:2CH3CH2OH+O2 $→_{△}^{Cu}$2CH3CHO+2H2O、2CH3CHO+O2 $\stackrel{催化剂}{→}$ 2CH3COOH;
(4)某有机物Y比乙烯多2个碳原子,且与乙烯物质互为同系物关系,1H核磁共振谱图显示有2条峰谱且面积之比为9:1,Y的结构简式应为(CH3)3C-OH,
故答案为:(CH3)3C-OH.
点评 本题考查有机物推断,为高考常见题型,侧重于学生的分析能力的考查,注意确定烯烃M是关键,再结合转化关系推断,注意官能团的性质与转化,难度不大.


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:实验题
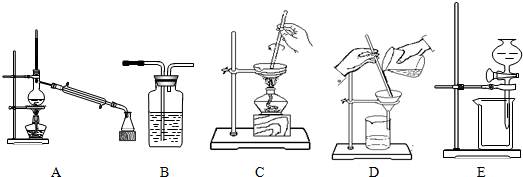
| 实验 | 所需分离操作 |
| 1.某活动小组用海水制取粗盐 | |
| 2.某活动小组从原油中分离出汽油、煤油等 | |
| 3.某活动小组将粗盐溶于水,除去其不溶的泥沙 | |
| 4.某活动小组用氢氧化钠溶液洗去CCl4中的I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 操 作 | 现 象 |
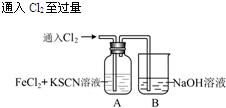 | I.A中溶液变红 Ⅱ.稍后,溶液由红色变为黄色 |
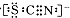
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
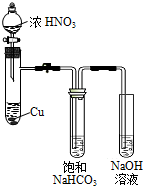 某化学学习小组发现在碱性溶液中,NO2会发生如下反应:
某化学学习小组发现在碱性溶液中,NO2会发生如下反应:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 编号 | 反应温度 (利用水浴加热) | 稀硫酸 溶液 | MnSO4固体 | 0.10mol/L KMnO4溶液 | 褪色 时间 |
| 1 | 65℃ | ---- | --- | 1mL | 100s |
| 2 | 65℃ | 10滴 | --- | 1mL | 90s |
| 3 | 75℃ | 10滴 | ---- | 1mL | 40s |
| 4 | 75℃ | 10滴 | 加入少许 | 1mL | 3s |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com