
【题目】取9.28g Na2CO3·x H2O溶于水配成5mL溶液,然后逐滴滴入稀盐酸直至没有气体放出为止,用去盐酸20mL,并收集到896mL CO2(标准状况下)。求:
(1)稀盐酸的物质的量浓度;________
(2)x的值。_________
【答案】4mol/L 7
【解析】
(1)根据n=![]() 计算出生成二氧化碳的物质的量,然后利用方程式 Na2CO3+2HCl=2NaCl+CO2↑+H2O计算出消耗HCl的物质的量,最后利用c=
计算出生成二氧化碳的物质的量,然后利用方程式 Na2CO3+2HCl=2NaCl+CO2↑+H2O计算出消耗HCl的物质的量,最后利用c=![]() 计算该元素的浓度;
计算该元素的浓度;
(2)根据碳元素守恒可知n(Na2CO3xH2O)=n(Na2CO3),然后根据M=![]() 计算Na2CO3XH2O的摩尔质量,再根据M(Na2CO3xH2O)列式计算出x。
计算Na2CO3XH2O的摩尔质量,再根据M(Na2CO3xH2O)列式计算出x。
标况下896mL二氧化碳的物质的量n(CO2)=![]() =0.04mol,
=0.04mol,
Na2CO3 + 2HCl=2NaCl+CO2↑+H2O
1 2 1
n(Na2CO3) n(HCl) 0.04mol
(1)n(HCl)=2×n(CO2)=2×0.04mol=0.08mol,盐酸的物质的量浓度为:c(HCl)=![]() =4.0mol/L,答:盐酸的物质的量浓度为4.0mol/L;
=4.0mol/L,答:盐酸的物质的量浓度为4.0mol/L;
(2)n(Na2CO3xH2O)=n(Na2CO3)=0.04mol,则Na2CO3XH2O的摩尔质量为:M(Na2CO3xH2O)=![]() =232g/mol,则106+18x=232,解得:x=7,答:x的值为7。
=232g/mol,则106+18x=232,解得:x=7,答:x的值为7。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】对达到化学平衡状态的可逆反应:A+B ![]() C+D,若t0时增大压强,正、逆反应速率变化如图所示(v代表反应速率,t代表时间),下列有关A、B、C、D的状态叙述中正确的是( )
C+D,若t0时增大压强,正、逆反应速率变化如图所示(v代表反应速率,t代表时间),下列有关A、B、C、D的状态叙述中正确的是( )

A.A、B、C是气体,D不是气体
B.A、B是气体,C、D有一种是气体
C.C、D是气体,A、B有一种是气体
D.C、D有一种是气体,A、B都不是气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铅蓄电池为外电源,![]() 作阳极、
作阳极、![]() 作阴极,电解稀硫酸,使铝表面的氧化膜增厚。已知:
作阴极,电解稀硫酸,使铝表面的氧化膜增厚。已知:
铅蓄电池中的总反应方程式为:![]()
电解的化学方程式: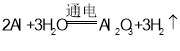
对该电解过程,下列判断错误的是( )
A.电解池:溶液的![]() 减小
减小
B.电解池: ![]() 移向
移向![]() 电极
电极
C.铅蓄电池:负极质量不变
D.铅蓄电池:工作一段时间后,进行充电时铅蓄电池的负极接电源的负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.8 g CO和0.2 g H2在足量的氧气中充分燃烧,使生成的CO2和水蒸气通过过量的过氧化钠,完全反应后固体的质量变化量是( )
A. 增加了3.0 gB. 减少了3.0 gC. 增加了2.6 gD. 减少了2.6 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.32g碳酸钠、氢氧化钠的固体混合物完全溶解于水,制成溶液,然后向该溶液中逐滴加入1mol/L的盐酸,所加盐酸的体积与产生CO2的体积(标准状况)关系如下图所示,下列说法中正确的是( )
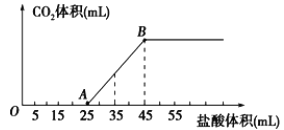
A.OA段发生反应的离子方程式为:H++OH-→H2O
B.B当加入35mL盐酸时,产生CO2的体积为224mL
C.A点溶液中的溶质为NaC1、Na2CO3
D.混合物中NaOH的质量0.60g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KMnO4在医疗上有广泛地应用,可用于防腐、制药、消毒等。现以软锰矿(主要成分为MnO2,含有少量Al2O3、SiO2等)为原料制备KMnO4的工业流程如图所示。

(1)料渣的主要成分是____,操作2的意义是__________。
(2)“调pH”的目的是__________;写出“氧化”过程中发生反应的离子方程式:________;熔融过程中,氧化剂与还原剂的物质的量之比为_______。
(3)操作3的内容为蒸发浓缩、趁热过滤、洗涤、烘干,已知KHCO3、KMnO4的溶解度曲线是下图中的两种,则KHCO3、KMnO4的溶解度曲线分别是_____(填序号)。

(4)用惰性电极电解K2MnO4溶液也可得到目标产物,则生成目标产物的电极反应式为___________,充分电解后,得到的溶液中溶质的主要成分是______和KMnO4。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.一个CsCl晶胞中含有8个Cl-。
B.离子晶体类的物质均是电解质,故离子晶体均能导电。
C.锗和碳都存在具有原子晶体结构的单质,锗和碳都易形成四个键,能形成原子晶体结构。
D.某物质是由X(黑球)、Y(白球)两种微粒构成的,它们在二维平面中的排列情况为![]() ,则该物质化学式为XY2。
,则该物质化学式为XY2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分
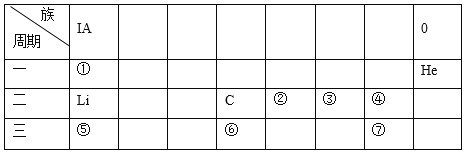
(1)表中非金属性最强的元素为__________(填写元素符号)。
(2)写出元素⑦最高价氧化物对应水化物的化学式___________。
(3)表中元素③和⑤可以组成原子比例为1:1的物质,元素②可以组成一种常见的气体单质,请画出两种分子的电子式____________、____________。
(4)表中元素④⑦氢化物的稳定性由大到小的顺序为:__________ (填写化学式)。
(5)表中有一种元素的单质可作为半导体材料,它在元素周期表中的位置是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合硫酸铁(简称PFS或聚铁)是水处理中重要的絮凝剂。以黄铁矿的烧渣(主要成分为Fe2O3、FeO、SiO2等)为原料制取聚合硫酸铁(![]() )的工艺流程如下:
)的工艺流程如下:
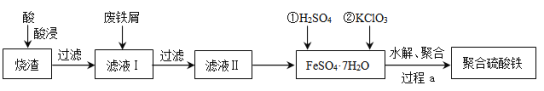
(1)酸浸时最合适的酸是_____(写化学式)。
(2)酸浸后溶液中主要的阳离子有_____。
(3)加入KClO3的目的是_____________________________(结合离子方程式说明)。
(4)过程a中生成聚合硫酸铁的过程是先水解再聚合。将下列水解反应原理的化学方程式补充完整。
_____Fe2(SO4)3+_____H2O![]() ______Fe2(OH)x(SO4)3-
______Fe2(OH)x(SO4)3-![]() + _____ ______
+ _____ ______
(5)过程a中水解要严控pH的范围。pH偏小或偏大聚合硫酸铁的产率都会降低,请解释原因__________。
(6)盐基度B是衡量絮凝剂絮凝效果的重要指标,通常盐基度越高,絮凝效果越好。盐基度B的表达式:![]() (n为物质的量)。为测量聚合硫酸铁的盐基度,进行如下实验操作:
(n为物质的量)。为测量聚合硫酸铁的盐基度,进行如下实验操作:
ⅰ.取聚合硫酸铁样品m g,加入过量盐酸,充分反应,再加入煮沸后冷却的蒸馏水,再加入KF溶液屏蔽Fe3+,使Fe3+不与OH-反应。然后以酚酞为指示剂,用c mol/L的标准NaOH溶液进行中和滴定,到终点时消耗NaOH溶液V mL。
ⅱ.做空白对照实验,取与步骤ⅰ等体积等浓度的盐酸,以酚酞为指示剂,用c mol/L的标准NaOH溶液进行中和滴定,到终点时消耗NaOH溶液V0 mL。
①该聚合硫酸铁样品中n(OH-) =_________mol。
②已知该样品中Fe的质量分数w,则盐基度B=_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com