
把20.95g干燥的氯酸钾与二氧化锰的混合物装入大试管中,加热到质量不变为止,剩余固体为16.15g,则:
(1)求生成的气体在标态下的体积
(2)剩余固体各成分的物质的量
(3)向剩余固体中加入过量的浓硫酸,全部氯元素成为两种含氯的混合气体,通入过量的碘化钾溶液,生成的碘被0.02mol Na2S2O3吸收,则生成的两种气体的体积(标态)是多少升?(已知:2Na2S2O3 +I2 → Na2S4O6+2NaI)
(1)3.36L (2)KCl 0.1mol MnO2 0.1mol (3)Cl2 0.224L HCl 1.792L
解析试题分析:(1)根据质量守恒定律可知,生成的氧气质量是20.95g-16.15g=4.8g
氧气在标准状况下的体积是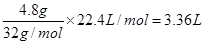 。
。
(2)根据方程式可知
2KClO3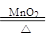 2KCl + 3O2↑
2KCl + 3O2↑
2mol 2mol 3mol
0.1mol 0.1mol 0.15mol
所以反应后剩余固体中氯化钾的物质的量0.1mol
氯化钾的质量是74.5g/mol×0.1mol=7.45g
则二氧化锰的质量是16.15g-7.45g=8.7g
因此二氧化锰的物质的量是8.7g÷87g/mol=0.1mol
(3)在加热的条件下,氯化钾和浓硫酸反应生成氯化氢,然后生成的氯化氢再被二氧化锰氧化生成氯气。根据方程式 Cl2+2KI=2KCl+I2、I2+2Na2S2O3=2NaI+Na2S4O6可知:
Cl2 ~ 2Na2S2O
1mol 2mol
0.01mol 0.02mol
即生成的氯气是0.01mol
标准状况下的体积是0.224L
根据氯原子守恒可知
生成的氯化氢是0.1mol-0.01mol×2=0.08mol
在标准状况下的体积是0.08mol×22.4L/mol=1.792L
考点:考查氯酸钾制备氧气、实验室制备氯气以及氧化还原反应的有关计算
点评:该题是高考中的常见题型,属于中等难度试题的考查,侧重对学生解题能力的培养。试题综合性强,贴近高考,旨在培养学生分析、归纳、总结问题的能力。有利于调动学生的学习兴趣和学习积极性,也有助于培养学生的逻辑推理能力和逆向思维能力,有助于提升学生的学科素养。该题的关键是明确反应原理,然后结合质量守恒定律、原子守恒以及电子的得失守恒灵活运用即可。


科目:高中化学 来源:2015届上海市高一上期末考试化学试卷(解析版) 题型:计算题
把20.95g干燥的氯酸钾与二氧化锰的混合物装入大试管中,加热到质量不变为止,剩余固体为16.15g,则:
(1)求生成的气体在标态下的体积
(2)剩余固体各成分的物质的量
(3)向剩余固体中加入过量的浓硫酸,全部氯元素成为两种含氯的混合气体,通入过量的碘化钾溶液,生成的碘被0.02mol Na2S2O3吸收,则生成的两种气体的体积(标态)是多少升?(已知:2Na2S2O3 +I2 → Na2S4O6+2NaI)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com