
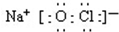 .
.分析 (1)氯的原子序数为17,原子核外有3个电子层,最外层电子数为7,以此可确定在周期表中的位置;
(2)根据次氯酸钠是离子化合物,氧原子和氯原子共用1对共用电子对;
(3)A、无氧酸的酸性,取决于非金属的电负性,电负性越大,酸性越弱;
B、原子半径越大,共价键键长越大,键能越小;
C、结构和组成相似的分子晶体,相对分子质量越大,分子间作用力越大,有氢键的熔点变大;
D、元素的非金属性越强,对应氢化物的还原性越弱;
(4)常温下,0.1mol/L的NaClO溶液的pH=9.7,溶液显碱性,次氯酸钠溶液中次氯酸根离子水解显碱性,电离平衡常数K=$\frac{[Cl{O}^{-}][{H}^{+}]}{[HClO]}$,依据水解平衡常数和溶液中离子积常数计算,洁厕液与84消毒液混合后会生成有毒的氯气,是洁厕净中盐酸和84消毒液中氯离子、次氯酸根离子发生氧化还原反应生成氯气;
(5)①在碱性条件下,利用NaClO氧化硝酸铁,制得Na2FeO4,结合电荷守恒和原子守恒配平书写离子方程式;
②选择的洗涤剂应能抑制K2FeO4的水解,并注意减少K2FeO4的溶解.
(6)设质量都是71g,利用单位质量得到的电子数来分析消毒效率.
解答 解:(1)氯的原子序数为17,原子核外有3个电子层,最外层电子数为7,则应位于周期表第三周期ⅦA族,
故答案为:第三周期ⅦA 族;
(2 )次氯酸钠是离子化合物,氧原子和氯原子共用1对共用电子对,电子式为: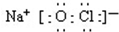 ,
,
故答案为: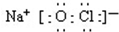 ;
;
(3)A、F、Cl、Br、I的电负性依次减弱,电负性越大,酸性越弱,故其氢化物的酸性依次增强,故A错误;
B、原子半径越大,共价键键长越大,键能越小,原子半径:F<Cl<Br<I,则共价键的键长:H-F<H-C1<H-Br<H-I,键能:H-F>H-Cl>H-Br>H-I,故B正确;
C、四种物质都是分子晶体,组成和结构相似,分子的相对分子质量越大,分子间作用力越大,则其熔沸点越高,但是HF中氢键熔点反常,比卤素的其他氢化物熔点高,所以熔点由低到高:HCl<HBr<HI<HF,故C错误;
D、元素的非金属性越强,对应氢化物的还原性越弱,因为非金属性:F>Cl>Br>I,故还原性:HF<HCl<HBr<HI,故D正确,
故选:AC;
(4)常温下,0.1mol/L的NaClO溶液的pH=9.7,溶液显碱性,次氯酸钠溶液中次氯酸根离子水解显碱性,反应的离子方程式为:ClO-+H2O?HClO+OH-,常温下,0.1mol/L的NaClO溶液的pH=9.7,ClO-+H2O?HClO+OH-,Kh=$\frac{[O{H}^{-}][HClO]}{[Cl{O}^{-}]}$=$\frac{[O{H}^{-}][HClO]}{[Cl{O}^{-}]}$×$\frac{[{H}^{+}]}{[{H}^{+}]}$=$\frac{Kw}{Ka}$,则Ka=$\frac{1{0}^{-14}}{\frac{[O{H}^{-}][HClO]}{[Cl{O}^{-}]}}$=$\frac{1{0}^{-14}×0.1mol/L}{1{0}^{-4.3}×1{0}^{-4.3}}$=10-6.4,
次氯酸钠有强氧化性,盐酸有强还原性,两者相遇发生氧化还原反应生成氯气,方程式为:NaClO+2HCl═NaCl+Cl2↑+H2O,离子方程式为:ClO-+Cl-+2H+=Cl2↑+H2O,
故答案为:次氯酸根离子水解溶液显碱性,ClO-+H2O?HClO+OH-,10-6.4,ClO-+Cl-+2H+=Cl2↑+H2O;
(5)①在碱性条件下,利用NaClO氧化硝酸铁,制得Na2FeO4,该反应的离子反应方程式为2Fe3++3ClO-+10OH-=2FeO42-+5H2O+3Cl-,
故答案为:2Fe3++3ClO-+10OH-=2FeO42-+5H2O+3Cl-,
②为抑制K2FeO4的水解,应在碱性条件下洗涤,可用CH3COONa,为防止K2FeO4的溶解,可用异丙醇洗涤,
故答案为:d;
(6)设质量都是71g,氯气得到的电子数为 $\frac{71g}{71g/mol}$×2×1=2mol,
NaClO得到的电子数为 $\frac{71g}{74.5g/mol}$×1×2=$\frac{142}{74.5}$ mol,
则Cl2消毒的效率是NaClO的倍数为=$\frac{2}{\frac{142}{74.5}}$=$\frac{149}{142}$,
故答案为:149:142;
点评 本题综合考查氯的化合物的性质以及卤素的性质比较,题目较为综合,难度较大,注意把握题给信息,尤其是氧化还原反应知识的运用.


科目:高中化学 来源: 题型:选择题
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 任何放热反应在常温条件下一定能自发进行 | |
| C. | 反应物和生成物所具有的总焓决定了反应是放热还是吸热 | |
| D. | 放热反应在任何条件下也能发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1句 | B. | 2句 | C. | 3句 | D. | 4句 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,11.2 L Cl2含有的分子数为0.5NA | |
| B. | 在常温常压下,17 g NH3所含的原子数为4NA | |
| C. | 标准状况下,11.2 L CCl4所含的分子数为0.5NA | |
| D. | 56g金属铁与足量的氯气反应时,失去的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅和氯化镁熔化 | B. | 碘和氯化铵受热变成气体 | ||
| C. | 碘和干冰的升华 | D. | 氯化钠和氯化氢溶于水 | ||
| E. | 硅和蔗糖的熔化 | F. | 酒精和水的挥发 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150mL1mol•L-1NaCl溶液 | B. | 75mL2mol•L-1CaCl2溶液 | ||
| C. | 150mL3mol•L-1KCl溶液 | D. | 75mL3mol•L-1FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
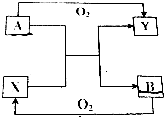 已知A、B、X、Y四种常见物质(其中A、B为单质,X、Y为化合物)有如图所示的转化关系(反应条件已略去);则X不可能为( )
已知A、B、X、Y四种常见物质(其中A、B为单质,X、Y为化合物)有如图所示的转化关系(反应条件已略去);则X不可能为( )| A. | CO2 | B. | H2O | C. | Fe3O4 | D. | SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L | B. | 0.2mol/L | C. | 0.4mol/L | D. | 0.8mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com