
 分子筛具有均匀的微孔结构,分子筛筛分作用见图.
分子筛具有均匀的微孔结构,分子筛筛分作用见图.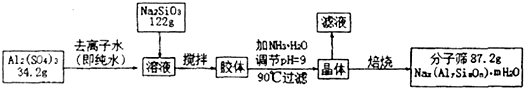
| ? |
| A |
| ? |
| A |
| ? |
| A |
| ? |
| A |
| 34.2g |
| 3442g/mol |
| 122g |
| 122g/mol |
| 87.2g-0.1mol×102g/mol-1mol×60g/mol-0.1mol×62g/mol |
| 18g/mol |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、溶于硝酸银溶液,观察是否有白色沉淀生成 |
| B、溶于水做导电实验,观察是否导电 |
| C、熔融状态,做导电实验,观察是否导电 |
| D、测定氯化铍熔点 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2O、HCOOH、Cu2(OH)2CO3均含有氧元素,都是氧化物 |
| B、HCOOH、H2CO3、H2SO4分子中均含有两个氢原子,都是二元酸 |
| C、HF、CH3CH2OH、NaOH都易溶于水,都是电解质 |
| D、HClO、H2SO4(浓)、HNO3均具有强氧化性,都是氧化性酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据,回答下列问题:
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 425 |
查看答案和解析>>
科目:高中化学 来源: 题型:
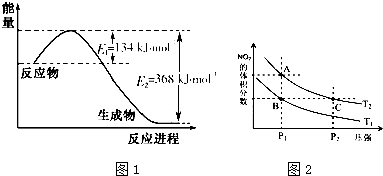 氮是地球上含量丰富的一种元素,氮及其化合物在生产、生活中有着重要作用.
氮是地球上含量丰富的一种元素,氮及其化合物在生产、生活中有着重要作用.| T/K | 298 | 398 | 498 |
| 平衡常数K | 4.1×106 | K1 | K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①④ | B、①③ | C、②④ | D、③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
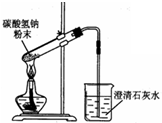
| A、用如图装置加热碳酸氢钠粉末 |
| B、蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 |
| C、过滤时,若发现滤液浑浊,应更换滤纸,重新过滤 |
| D、制备Fe(OH)3胶体是向盛有沸水的烧杯中滴加FeCl3饱和溶液并长时间煮沸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com