
【题目】氨气是一种重要的物质,可用于制取化肥和硝酸等.已知H﹣H键、N﹣H键、N≡N键的键能分别是436kJ/mol、391kJ/mol、946kJ/mol.
(1)写出合成氨的热反应方程式 .
生成1molNH3需要吸收或放出kJ
(2)当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如右图所示.图中t1 时引起平衡移动的条件可能是 . 其中表示平衡混合物中NH3的含量最高的一段时间是 . 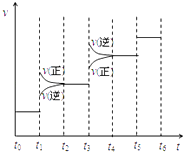
(3)温度为T℃时,将2a molH2和a molN2放入0.5L密闭容器中,充分反应后测得N2的转化率为50%.则该反应的平衡常数为 .
(4)已知373K时,可逆反应平衡常数为K=0.12,若某时刻时,测得 C(N2)=1mol/L,C(H2)=3mol/L,C(NH3)=2mol/L.此刻可逆反应
A.向正方向进行
B.向逆方向进行 C处于平衡状态.
【答案】
(1)N2(g)+3H2(g)=2NH3(g)△H=﹣92KJ/mol;46
(2)加压;t2﹣t3
(3)![]()
(4)B
【解析】解:(1)反应热=生成物总键能﹣反应物总键能,则该反应的反应热=6×391kJ/mol﹣946kJ/mol﹣3×436kJ/mol=﹣92KJ/mol,该反应热化学反应方程式为N2(g)+3H2(g)=2NH3(g)△H=﹣92KJ/mol,生成2mol氨气放出92kJ热量,则生成1mol氨气放出46kJ热量,所以答案是:N2(g)+3H2(g)=2NH3(g)△H=﹣92KJ/mol;46 KJ;(2)该反应是反应前后气体体积减小的放热反应,改变条件时,正逆反应速率都增大,且正反应速率大于逆反应速率,平衡向正反应方向移动,则改变的条件是加压,t3时平衡向逆反应方向移动,t5 时平衡不移动,所以平衡混合物中NH3的含量最高的一段时间是t2﹣t3 ,
所以答案是:加压;t2﹣t3;(3)氮气的转化率为50%,则平衡时c(N2)= ![]() =amol/L,c(NH3)=
=amol/L,c(NH3)= ![]() =2amol/L、c(H2)=
=2amol/L、c(H2)= ![]() =amol/L,化学平衡常数K=
=amol/L,化学平衡常数K= ![]() =
= ![]() ,所以答案是:
,所以答案是: ![]() ;(4)浓度商=
;(4)浓度商= ![]() =0.1481>0.12,则平衡向逆反应方向移动,故选B.
=0.1481>0.12,则平衡向逆反应方向移动,故选B.
【考点精析】利用化学平衡状态本质及特征对题目进行判断即可得到答案,需要熟知化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效).


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
【题目】绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)用绿矾晶体配制硫酸亚铁溶液时需加入少量铁粉,其目的是____________________,若绿矾失去了部分结晶水,会导致配制的溶液浓度__________(偏大、偏小、无影响)。
(2)设计实验检验绿矾晶体是否变质,写出实验方案:_______________________;
(3)若要检验硫酸铁溶液中是否含有Fe2+, 最好选用________________。
A.KSCN溶液、氯水 B. 酸性KMnO4溶液 C. NaOH溶液 D. H2O2溶液
(4)为测定绿矾中结晶水含量,将石英玻璃管(带端开关K1和K2)(装置A)称重,记为m 1 g。将样品装入石英玻璃管中,再次将装置A称重,记为m 2 g。按下图连接好装置进行实验。
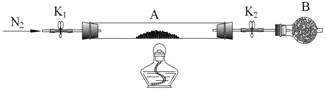
①仪器B的名称是____________________。
②用N2排净装置中的空气,加热装置A,使其彻底失去结晶水直至A恒重,记为m3 g。
③根据实验记录,计算绿矾化学式中结晶水数目x=________________(列式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.lmol/L的NH4Fe(SO4)2溶液中,下列各组离子能大量共存的是( )
A.Ca2+、Mg2+、CH3COO-、SCN-B.K+、Na+、CO32-、OH-
C.Cu2+、Al3+、Cl-、NO3-D.H+、Ba2+、Br-、I-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF,NO和HNO3 , 请根据要求回答下列问题:
(1)反应过程中,被氧化与被还原的元素原子的物质的量之比为 .
(2)写出该反应的化学方程式 . 若反应中生成0.2mol HNO3 , 转移的电子数目为个.
(3)NF3是一种无色、无臭的气体,但一旦NF3在空气中泄漏,还是易于发现.你判断该气体泄漏时的现象是 .
(4)一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少污染,其产物除NaNO2、NaF,H2O外,还肯定有(填化学式).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一定温度下的密闭容器中存在如下反应:2SO2(g)+O2(g)2SO3(g),已知c(SO2)=0.4mol/L,c(O2)=1mol/L,经测定该反应在该温度下的平衡常数K=19,试判断:
(1)当SO2的转化率为50%时,该反应是否达到平衡状态,若未达到,向哪个方向进行?
(2)达平衡状态时,SO2的转化率应为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硫酸盐是一种常见的食品添加剂,用如图实验可检验某食品中亚硫酸盐含量(所 加试剂均足量). ![]()
下列说法不正确的是( )
A.亚硫酸盐作为食品添加剂,作用是防腐保鲜
B.反应①过程中通入N2的作用是将装置中空气和生成的气体全部赶出
C.测定样品质量及③中耗碱量,可测定样品中亚硫酸盐含量
D.若仅将②中的氧化剂“H2O2溶液”替换为碘水,对测定结果无影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某可逆反应mA(g)+nB(g)pC(g),在密闭容器中进行,如图表示在不同反应时间t、温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线,由曲线分析,下列判断正确的是( ) 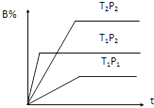
A.T1<T2、P1>P2、m+n>p,△H<0
B.T1>T2、P1<P2、m+n>p,△H>0
C.T1>T2、P1<P2、m+n<p,△H>0
D.T1<T2、P1>P2、m+n<p,△H<0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com