
| A. | 短周期元素中,最外层电子数是其电子层数两倍的元素共有3种 | |
| B. | 第三周期元素的离子半径大小比较:S2->Cl->Na+>Mg2+>Al3+ | |
| C. | 日本核电站释放出的131I、132I和133I属于同素异形体 | |
| D. | 相同条件下,测定同浓度的Na2CO3溶液和Na2SO4溶液的pH,可比较C和S的非金属性强弱 |
分析 A.短周期元素中,最外层电子数是其电子层数两倍的元素有He、C、S;
B.电子层越多,离子半径越大,具有相同电子排布的离子原子序数大的离子半径小;
C.131I、132I和133I为质子数相同,中子数不同的原子;
D.测定同浓度的Na2CO3溶液和Na2SO4溶液的pH,可知酸性为硫酸>碳酸,以此比较非金属性.
解答 解:A.短周期元素中,最外层电子数是其电子层数两倍的元素有He、C、S,共3种,故A正确;
B.电子层越多,离子半径越大,可知S2-、Cl-离子半径大于Na+、Mg2+、Al3+,具有相同电子排布的离子原子序数大的离子半径小,则离子半径为S2->Cl->Na+>Mg2+>Al3+,故B正确;
C.131I、132I和133I为质子数相同,中子数不同的原子,则互为同位素,故C错误;
D.测定同浓度的Na2CO3溶液和Na2SO4溶液的pH,可知酸性为硫酸>碳酸,可知非金属性S>C,故D正确;
故选C.
点评 本题考查元素性质,为高频考点,侧重考查学生知识迁移能力,把握元素的位置、性质及元素周期律、相关概念的应用等为解答的关键,综合性较强,题目难度不大.


科目:高中化学 来源: 题型:解答题
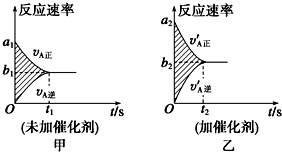
| 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) |
| 0 min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | |||
| 20min | 1 | |||
| 30min | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 元素编号 | 元素性质或原子结构 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 第三周期元素的简单离子中半径最小 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:NH3<PH3<H2O | |
| B. | P元素最高价氧化物对应的水化物酸性比Cl的强 | |
| C. | 碱性:NaOH>Mg(OH)2>Al(OH)3 | |
| D. | 元素非金属性:O>F |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
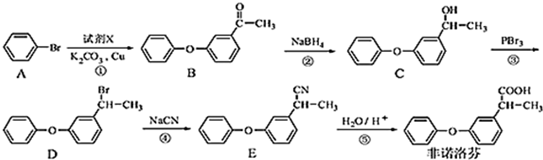
 .
. .
. 为原料制备
为原料制备 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOCH2CH3.
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOCH2CH3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在含有大量I-离子的溶液中:Cl?、Fe3+、Al3+、Cu2+ | |
| B. | 滴加石蕊试液显红色的溶液:Fe2+、NH4+、Cl-、NO3-能够大量共存 | |
| C. | pH=13的溶液:S2-、SO32-、SO42-、Na+ | |
| D. | 在加入Al能放出大量H2的溶液中:NH4+、SO42?、C1?、HCO3? |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 2mol/LAgNO3溶液 | B. | 2mol/LNaOH溶液 | C. | 2mol/LMgSO4溶液 | D. | Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性由强到弱的顺序为HCN>HClO>CH3COOH | |
| B. | 0.1mol?L-1 NaClO溶液的碱性一定比0.1 mol?L-1 CH3COONa强 | |
| C. | 等物质的量浓度的CH3COONa溶液和醋酸溶液都促进了水的电离 | |
| D. | a mol?L-1HCN溶液与b mol?L-1NaOH溶液等体积混合,溶液中c(Na+)=c(CN-),则a=b |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NaOH溶液 | B. | 饱和Na2CO3溶液 | C. | 饱和NaHCO3溶液 | D. | 饱和氯化钠溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com