
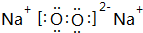
 ;属于离子化合物(填“离子”或“共价”);
;属于离子化合物(填“离子”或“共价”); ;属于共价化合物(填“离子”或“共价”);
;属于共价化合物(填“离子”或“共价”);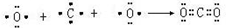 ;
;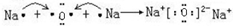 .
. 分析 有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,已知A原子核内无中子,应为H元素; B和C原子有相同的电子层数,位于相同周期,且B的最外层电子数是次外层电子数的两倍,则B为C元素,A和D、C和E分别同主族,D的单质在足量C单质燃烧生成淡黄色固态化合物,则C为O元素,D为Na元素,E为S元素,F与E相邻,应为Cl元素,以此解答该题.
解答 解:有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,已知A原子核内无中子,应为H元素; B和C原子有相同的电子层数,位于相同周期,且B的最外层电子数是次外层电子数的两倍,则B为C元素,A和D、C和E分别同主族,D的单质在足量C单质燃烧生成淡黄色固态化合物,则C为O元素,D为Na元素,E为S元素,F与E相邻,应为Cl元素,
(1)由以上分析可知,A、B、C、D、E、F分别属于氢、碳、氧、钠、硫、氯,故答案为:氢;碳;氧;钠;硫;氯;
(2)F为Cl元素,位于周期表第三周期第ⅦA族,故答案为:第三周期第ⅦA族;
(3)D单质在足量C单质中燃烧生成的化合物为过氧化钠,属于离子化合物,电子式为 ,E为S,对应的氢化物为共价化合物,电子式为
,E为S,对应的氢化物为共价化合物,电子式为 ,
,
故答案为: ;离子;共价;
;离子;共价;
(4)二氧化碳是氧原子和碳原子之间通过共价键形成的共价化合物,形成过程为: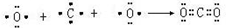 ,
,
氧化钠为离子化合物,形成过程为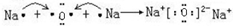 ,
,
故答案为: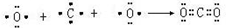 ;
;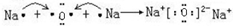 .
.
点评 本题考查结构性质位置关系应用,题目难度中等,推断元素是解题关键,注意对基础知识的理解掌握,试题涉及的知识点较多、综合性较强,充分考查了学生的分析、理解能力及灵活应用基础知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | NH4Fe(SO4)2•12H2O | B. | NH4Al(SO4)2•12H2O | C. | (NH4)2Fe(SO4)2•6H2O | D. | (NH4)2Fe(SO4)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T/℃ | 0 | 10 | 20 | 30 | 40 |
| S(g/100g水) | 11.5 | 15.1 | 19.4 | 24.4 | 37.6 |
| NaNO3 | KNO3 | NaCl | KCl | |
| 10℃ | 80.5 | 20.9 | 35.7 | 31.0 |
| 100℃ | 175 | 246 | 39.1 | 56.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
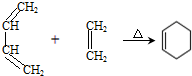

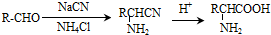
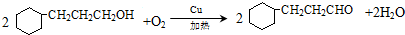 .
.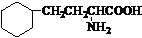 .写出满足下列条件的苯丙氨酸同分异构体的结构简式
.写出满足下列条件的苯丙氨酸同分异构体的结构简式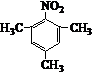 、
、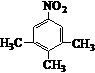 .
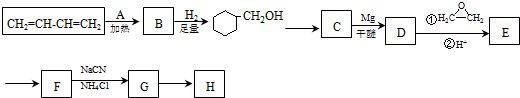
.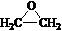 )制备1,4-戊二烯的合成路线(无机试剂任选).
)制备1,4-戊二烯的合成路线(无机试剂任选).查看答案和解析>>
科目:高中化学 来源: 题型:多选题
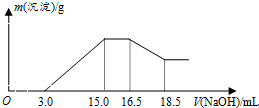
| A. | 铝与混合溶液反应的离子方程式为8Al+30H++3NO3-→8Al3++3NH4++9H2O | |
| B. | 参加反应硝酸根离子物质的量为0.06mol | |
| C. | 参加反应的铝与镁的质量之比为4:3 | |
| D. | 混合液中硫酸的物质的量的浓度为0.36mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com