
(NH4)2Fe(SO4)2·6H2O俗名摩尔盐,价格便宜,可用来净水或治疗缺铁性贫血等,是一种重要的化工原料。
(1)摩尔盐的水溶液呈 色。
(2)c(Fe2+)相同的摩尔盐和硫酸亚铁两溶液比较,物质的量浓度较大的是 。
(3)甲乙两位同学想测定一瓶摩尔盐的纯度。甲同学设计的实验装置如下图:
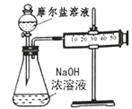
从上图推断甲同学想通过测定 计算摩尔盐的纯度。该方案的不足之处在于 。
(4)乙同学在甲同学的基础上做了改进,其实验装置如下图:
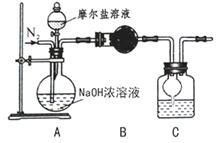
则B与C中的试剂分别是 和 。C中干燥管的作用是 。乙同学称取了 10.0g的摩尔盐样品,若实验完毕后测得洗气瓶及瓶内溶液共增重 0.68g,则依此数据推算这份摩尔盐的纯度为 %(答案精确到小数点后第一位)。
【知识点】性质实验方案的设计;探究物质的组成或测量物质的含量 J5
【答案解析】(1)浅绿(2)硫酸亚铁
(3)生成氨气的体积 ;氨气有一部分会溶解在溶液中(或“未加热”等其它合理解释)
(4)碱石灰;稀硫酸 ;防止倒吸; 78.4(3分)
解析: (1)(NH4)2Fe(SO4)2•6H2O溶于水中电离出亚铁离子,所以溶液为浅绿色;
(2)(NH4)2Fe(SO4)2•6H2O的溶液中,铵离子水解溶液显示酸性,抑制了亚铁离子的水解,故相同浓度的莫尔盐和硫酸亚铁,莫尔盐中的亚铁离子浓度较大,若c(Fe2+)相同,硫酸亚铁的物质的量浓度要大些;
(3)从图1药品为莫尔盐和氢氧化钠,说明甲同学想通过测定生成氨气的体积计算摩尔盐的纯度;由于氨气极易溶于水,所以溶液中一定含有部分氨气没有逸出;
(4)根据图2可知,装置B为干燥装置,干燥氨气可以使用碱石灰;装置C为吸收并测定生成氨气的装置,可以使用稀硫酸;氨气极易溶于水,吸收时需要防止倒吸,使用C中干燥管的作用是防止倒吸;乙同学称取了10.0g的摩尔盐样品,若实验完毕后测得洗气瓶及瓶内溶液共增重O.68g,增重部分为氨气的质量,生成的氨气的物质的量为:0.68/17 mol=0.04mol,10.0g的摩尔盐样品中含有莫尔盐的物质的量为:0.02mol,所以这份摩尔盐的纯度为:
392g/mol×0.02mol/10g ×100%=78.4%。
【思路点拨】本题考查了探究物质组成、测定物质的含量的方法,题目难度中等,注意掌握探究物质组成、测定物质含量的方法,解题关键是明确实验原理。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:____________________。
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是 。
(3)吸收液吸收SO2的过程中,pH随n(SO32-)∶n(HSO3-)变化关系如下表:
| n(SO32-)∶n(HSO3-) | 91∶9 | 1∶1 | 9∶91 |
| pH | 8.2 | 7.2 | 6.2 |
①由上表判断,NaHSO3溶液显 性,用化学平衡原理解释: 。
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母) 。
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
(4)当吸收液的pH降至约为6时,需送至电解槽再生。再生示意图如下:
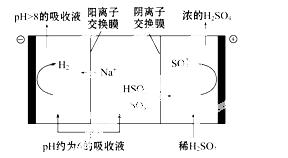
①HSO 3-在阳极放电的电极反应式是 。
3-在阳极放电的电极反应式是 。
②当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。简述再生原理:
。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是 ( )
A.CO、NO、NO2都是大气污染气体,在空气中都能稳定存在
B.NO可用于某些疾病的治疗
C.NO2通入FeSO4溶液中始终无明显现象
D.汽车尾气的主要污染成分包括NO、CO和N2
查看答案和解析>>
科目:高中化学 来源: 题型:
重铬酸钠二水合物Na2Cr2O7·2H2O广泛用作氧化剂、金属表面精整、皮革制作等。以铬矿石(Cr2O3,含FeO、Al2O3、SiO2等杂质)为原料制取重铬酸钠的流程如下:
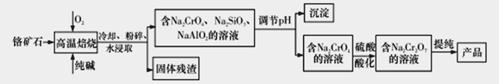
请回答下列问题:
(1)写出Cr2O3在高温焙烧生成Na2CrO4的化学方程式__________________________。
(2)调节pH后得到的沉淀主要是____________(填写化学式).
(3)写出用硫酸酸化使Na2CrO4转化为Na2Cr2O7的原理(写出离子方程式并加以文字说明):__________。
(4)氯化铬酸CrO2Cl2是红色液体,它可由Na2Cr2O7与NaCl的固体混合物和浓硫酸小心加热下制得,写出制备CrO2Cl2的化学反应方程式____________________________。
(5)某化工厂采用石墨作电极电解Na2CrO4溶液,实现Na2CrO4转化为Na2Cr2O7的生产,其原理如图所示。
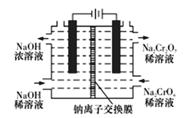
①通电后阳极区溶液的颜色变化为__________________________________。
②写出电解Na2CrO4溶液制备Na2Cr2O7的化学反应方程式:_______________________________。
③在电流为I A.通电时间为t s后,两极共收集到3.36 L气体(标准状况下),则阿伏加德罗常数的表达式NA =_____mol-1(己知电子的电量为1.6* 10-19C)。
(6)Na2Cr2O7可用于测定废水的化学耗氧量(即COD,指每升水样中还原性物质被氧化所需要的O2的质量,单位:mg·L-1),现有某水样200.00 mL,酸化后加入c1 mol/L的Na2Cr2O7溶液V1 mL,使水中的还原性物质完全被氧化(还原产物为Cr3+ );再用c2 mol/L的FeSO4溶液滴定剩余的Cr2O72-,结果消耗FeSO4溶液V2 mL。则该水样的COD为_____________mg·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
无机化合物A中含有元素Li元素,A的摩尔质量23g·mol-1,A主要用于有机合成和药物制造,同时也是良好的储氢材料。在一定条件下,0.1mol固体A与0.1molNH4Cl固体恰好完全反应,生成固体B和4.48L(标准状况)气体C。已知气体C极易溶于水,且得到碱性溶液。电解无水B可生成金属单质D和氯气。请回答下列问题:
(1)A的化学方式是_________________________。
(2)写出化合物A与NH4Cl反应的化学方程式:_______________________________。
(3)某同学通过查阅资料得知物质A的性质:
I.工业上可用金属D与液态的C在硝酸铁催化下反应来制备A物质。
II.物质A遇水强烈水解,释放出气体C。
①I中发生反应的基本反应类型是__________________________。
②物质A遇水强烈水解的化学方程式为_________________________。
(4)工业制备单质D的流程如下:

①步骤①中操作的名称为________________。
②试用平衡原理解释步骤③中减压的目的是:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机物A的分子式为C6H12O2,已知A~E有如图转化关系,且D不与Na2CO3溶液反应,C、E均能发生银镜反应,则A的结构可能有( )
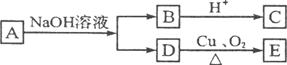
A.2种 B.3种 C.4种 D.5种
查看答案和解析>>
科目:高中化学 来源: 题型:
美、德两国成功合成具有化学特性的氢铝化合物(AlH3)n,关于氢铝化合物的推测不正确的是 ( )
A.氢铝化合物与水反应生成氢氧化铝和氢气
B.氢铝化合物中铝显+3 价,氢显-1价
价,氢显-1价
C.铝与水蒸气高温下反应生成氢铝化合物
D.氢铝化合物具有强还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.pH<7的溶液不一定是酸溶液
B.常温下,pH=5的溶液和pH=3的溶液相比,前者[OH-]不一定是后者的100倍
C.室温下,每1×107个水分子中只有一个水分子发生电离
D.在1 mol·L-1的氨水中,改变外界条件使[NH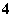 ]增大,则溶液的pH一定增大
]增大,则溶液的pH一定增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com