
 ,关于该物质的叙述错误的是( )
,关于该物质的叙述错误的是( )| A. | 一分子该物质中含有12个H原子 | |
| B. | 该物质的一氯代物有4种 | |
| C. | 该物质能使酸性KMnO4溶液褪色 | |
| D. | 1 mol该物质分别与足量H2、NaOH溶液反应,消耗H2、NaOH的物质的量均为3mol |
分析 该物质中含有酯基和苯环,具有酯和苯的性质,能发生取代反应、加成反应、水解反应,
A.该分子中含有12个H原子;
B.该物质结构不对称,其一氯代物有6种;
C.该物质苯环上含有甲基,能被酸性高锰酸钾溶液氧化;
D.该物质中苯环能和氢气发生加成反应,酯基水解生成的羧基和酚羟基能和氢氧化钠反应.
解答 解:该物质中含有酯基和苯环,具有酯和苯的性质,能发生取代反应、加成反应、水解反应,
A.根据结构简式知,该分子中含有12个H原子,故A错误;
B.该物质结构不对称,该分子中含有6种氢原子,所以其一氯代物有6种,故B错误;
C.该物质苯环上含有甲基,能被酸性高锰酸钾溶液氧化生成羧基,故C正确;
D.该物质中苯环能和氢气发生加成反应,酯基水解生成的羧基和酚羟基能和氢氧化钠反应,所以1 mol该物质分别与足量H2、NaOH溶液反应,消耗H2、NaOH的物质的量均为3mol,故D正确;
故选B.
点评 本题考查有机物结构和性质,为高频考点,侧重考查酯和苯的同系物性质,注意:只有连接苯环的碳原子上含有氢原子的苯的同系物才能被酸性高锰酸钾溶液氧化.


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能使酚酞变红色的溶液中:Na+,K+,OH-,S2O${\;}_{3}^{2-}$ | |
| B. | 在加入铝粉能产生氢气的溶液中:NH${\;}_{4}^{+}$,Fe2+,SO${\;}_{4}^{2-}$,NO${\;}_{3}^{-}$ | |
| C. | 室温下由水电离出的氢离子浓度c(H+)=1×10-14mol/L的溶液中:Ba2+,NO${\;}_{3}^{-}$,K+,F- | |
| D. | 含大量Cu2+的溶液中:NH${\;}_{4}^{+}$,Na+,Cl-,HS- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
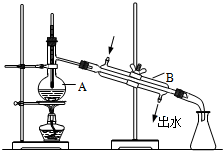 如图为实验室制取蒸馏水的装置示意图,请根据图示回答下列问题.
如图为实验室制取蒸馏水的装置示意图,请根据图示回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.12L | B. | 4.48L | C. | 5.6L | D. | 3.36L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 定容时俯视刻度线 | |
| B. | 容量瓶用前内壁沾有水珠 | |
| C. | 加蒸馏水时,不慎超过了刻度线,用胶头滴管吸出 | |
| D. | 称量NaCl时砝码与药品放反了 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com