
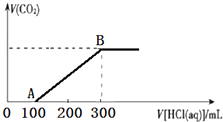
 200mLijĪļÖŹµÄĮæÅØ¶ČµÄNaOHČÜŅŗÖŠ»ŗĀżĶØČėŅ»¶ØĮæµÄCO2£¬³ä·Ö·“Ó¦ŗó£¬µĆµ½Na2CO3ŗĶNaHCO3µÄ»ģŗĻČÜŅŗ£®ĻņÉĻŹöĖłµĆČÜŅŗÖŠ£¬ÖšµĪµĪ¼Ó2mol•L-1µÄŃĪĖį£¬ĖłµĆĘųĢåµÄĢå»żÓėĖł¼ÓŃĪĖįµÄĢå»ż¹ŲĻµČēĶ¼ĖłŹ¾£ŗ
200mLijĪļÖŹµÄĮæÅØ¶ČµÄNaOHČÜŅŗÖŠ»ŗĀżĶØČėŅ»¶ØĮæµÄCO2£¬³ä·Ö·“Ó¦ŗó£¬µĆµ½Na2CO3ŗĶNaHCO3µÄ»ģŗĻČÜŅŗ£®ĻņÉĻŹöĖłµĆČÜŅŗÖŠ£¬ÖšµĪµĪ¼Ó2mol•L-1µÄŃĪĖį£¬ĖłµĆĘųĢåµÄĢå»żÓėĖł¼ÓŃĪĖįµÄĢå»ż¹ŲĻµČēĶ¼ĖłŹ¾£ŗ·ÖĪö ¼ÓČėŃĪĖį100mLŹ±æŖŹ¼Éś³ÉĘųĢ壬µ±¼ÓČėŃĪĖį300mLŹ±²»ŌŁ²śÉśĘųĢ壬ŌņNa2CO3ŗĶNaHCO3µÄ»ģŗĻČÜŅŗ£¬¼ÓŃĪĖįOA¶Ī·¢ÉśNa2CO3+HClØTNaHCO3+NaCl£¬¶ųAB¶Ī·¢ÉśNaHCO3+HClØTNaCl+H2O+CO2”ü£¬ŅŌ“Ė½ā“š
£Ø1£©OA¶ĪŹĒŌĢ¼ĖįÄĘŗĶŃĪĖį·“Ӧɜ³ÉĢ¼ĖįĒāÄĘĻūŗÄŃĪĖįĪŖ100ml£¬AB¶ĪŹĒČÜŅŗÖŠĢ¼ĖįĒāÄĘŗĶŃĪĖį·“Ӧɜ³É¶žŃõ»ÆĢ¼ĘųĢåĻūŗÄŃĪĖįĢå»ż200ml£»
£Ø2£©BµćŹ±ČÜÖŹÖ»ÓŠNaCl£¬½įŗĻĀČŌŖĖŲŗĶÄĘŌŖĖŲŹŲŗć¼ĘĖć£»
£Ø3£©½įŗĻ¼ÓČėŃĪĖį100mLŹ±æŖŹ¼Éś³ÉĘųĢ壬µ±¼ÓČėŃĪĖį300mLŹ±²»ŌŁ²śÉśĘųĢ壬ŌņNa2CO3ŗĶNaHCO3µÄ»ģŗĻČÜŅŗ£¬¼ÓŃĪĖįOA¶Ī·¢ÉśNa2CO3+HClØTNaHCO3+NaCl£¬¶ųAB¶Ī·¢ÉśNaHCO3+HClØTNaCl+H2O+CO2”ü£¬»Æѧ·½³ĢŹ½¶ØĮæ¹ŲĻµ¼ĘĖćµĆµ½Ō»ģŗĻĪļÖŠĢ¼ĖįÄĘŗĶĢ¼ĖįĒāÄĘĪļÖŹµÄĮ棻
½ā“š ½ā£ŗ¼ÓČėŃĪĖį100mLŹ±æŖŹ¼Éś³ÉĘųĢ壬µ±¼ÓČėŃĪĖį300mLŹ±²»ŌŁ²śÉśĘųĢ壬ŌņNa2CO3ŗĶNaHCO3µÄ»ģŗĻČÜŅŗ£¬¼ÓŃĪĖįOA¶Ī·¢ÉśNa2CO3+HClØTNaHCO3+NaCl£¬¶ųAB¶Ī·¢ÉśNaHCO3+HClØTNaCl+H2O+CO2”ü£¬
£Ø1£©OA¶ĪµÄĄė×Ó·“Ó¦ĪŖCO32-+H+=HCO3-£¬AB¶ĪµÄĄė×Ó·“Ó¦ĪŖHCO3-+H+=CO2”ü+H2O£¬
¹Ź“š°øĪŖ£ŗCO32-+H+=HCO3-£»HCO3-+H+=CO2”ü+H2O£»
£Ø2£©BµćŹ±ČÜÖŹÖ»ÓŠNaCl£¬n£ØNaCl£©=n£ØHCl£©=0.3L”Į2mol/L=0.6mol£¬ĖłŅŌc£ØNaCl£©=$\frac{0.6mol}{0.5L}$=1.2 mol•L-1£¬
¹Ź“š°øĪŖ£ŗ1.2 mol•L-1£»
£Ø3£©¼ÓČėŃĪĖį100mLŹ±æŖŹ¼Éś³ÉĘųĢ壬µ±¼ÓČėŃĪĖį300mLŹ±²»ŌŁ²śÉśĘųĢ壬ŌņNa2CO3ŗĶNaHCO3µÄ»ģŗĻČÜŅŗ£¬¼ÓŃĪĖįOA¶Ī·¢ÉśNa2CO3+HClØTNaHCO3+NaCl£¬¶ųAB¶Ī·¢ÉśNaHCO3+HClØTNaCl+H2O+CO2”ü£¬ĘäÖŠĢ¼ĖįÄĘÉś³ÉĢ¼ĖįĒāÄĘŠčŅŖµÄŃĪĖįĪļÖŹµÄĮæ=Ō»ģŗĻĪļÖŠĢ¼ĖįÄĘĪļÖŹµÄĮæ=0.1L”Į2mol/L=0.2mol£¬Ģ¼ĖįĒāÄĘŗĶŃĪĖį·“Ӧɜ³É¶žŃõ»ÆĢ¼ĘųĢåŠčŅŖŃĪĖį£Ø0.3-0.1£©L”Į2mol/L=0.4mol£¬ŌņŌĄ“»ģŗĻĪļÖŠĢ¼ĖįĒāÄĘĪļÖŹµÄĮæ=0.4mol-0.2mol=0.2mol£¬»ģŗĻČÜŅŗÖŠNa2CO3ŗĶNaHCO3µÄÖŹĮæ±Č=0.2mol”Į106g/mol£ŗ0.2mol”Į84g/mol=53£ŗ42£¬
¹Ź“š°øĪŖ£ŗ53£ŗ42£»
µćĘĄ ±¾Ģāæ¼²é»Æѧ·“Ó¦·½³ĢŹ½µÄ¼ĘĖć£¬ĢāÄæÄѶČÖŠµČ£¬×¢ŅāĶ¼ĻóÓė·“Ó¦µÄ¶ŌÓ¦¹ŲĻµ£¬²ąÖŲѧɜ·ÖĪöÅŠ¶ĻŗĶ¼ĘĖćÄÜĮ¦µÄ漲飬עŅāĶ¼ĻóÖŠBµćČÜŅŗČÜÖŹµÄÅŠ¶Ļ£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
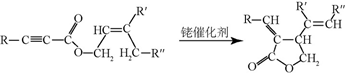
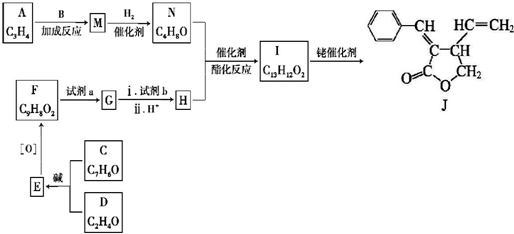
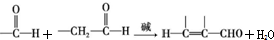
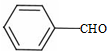 +CH3CHO$\stackrel{¼ī}{”ś}$
+CH3CHO$\stackrel{¼ī}{”ś}$ +H2O£®
+H2O£®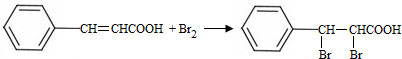 £»ŹŌ¼ĮbŹĒNaOH”¢“¼ČÜŅŗ£®
£»ŹŌ¼ĮbŹĒNaOH”¢“¼ČÜŅŗ£®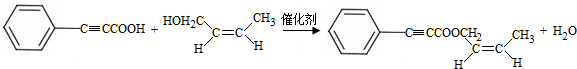 £®
£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
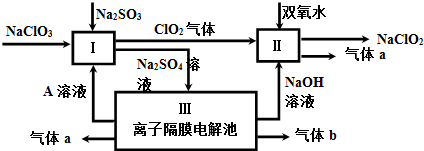
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
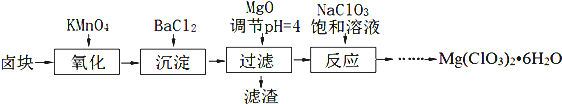
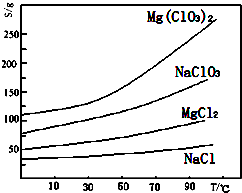
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¢Ł¢Ü¢Ž | B£® | ¢Ś¢Ū¢Ü | C£® | ¢Ł¢Ś¢Ü | D£® | ¢Ł¢Ś¢Ü¢ą |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
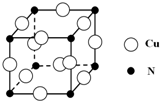 ÅšŗĶµŖŌŖĖŲŌŚ»Æѧ֊ӊŗÜÖŲŅŖµÄµŲĪ»£¬»Ų“šĻĀĮŠĪŹĢā£ŗ
ÅšŗĶµŖŌŖĖŲŌŚ»Æѧ֊ӊŗÜÖŲŅŖµÄµŲĪ»£¬»Ų“šĻĀĮŠĪŹĢā£ŗ £®Ō¤¼ĘÓŚ2017Äź·¢ÉäµÄ”°ęĻ¶šĪåŗÅ”±Ģ½²āĘ÷²ÉÓĆµÄ³¤Õ÷5ŗÅŌĖŌŲ»š¼żČ¼ĮĻĪŖĘ«¶ž¼×ėĀ[£ØCH3£©2NNH2]£®£ØCH3£©2NNH2ÖŠNŌ×ÓµÄŌӻƷ½Ź½ĪŖsp3£®
£®Ō¤¼ĘÓŚ2017Äź·¢ÉäµÄ”°ęĻ¶šĪåŗÅ”±Ģ½²āĘ÷²ÉÓĆµÄ³¤Õ÷5ŗÅŌĖŌŲ»š¼żČ¼ĮĻĪŖĘ«¶ž¼×ėĀ[£ØCH3£©2NNH2]£®£ØCH3£©2NNH2ÖŠNŌ×ÓµÄŌӻƷ½Ź½ĪŖsp3£®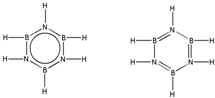 £®
£®²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com