
| n |
| V |
| ||
| 0.1mol |
| 0.15L |
| 3 |
| 2 |
| 1.12L |
| 22.4L/mol |
| 0.35mol |
| 0.15L |


科目:高中化学 来源: 题型:
A、工业上可用电解法制备Mg:MgCl2
| ||||
| B、自然界中正常的雨水呈酸性:H2O+CO2?H2CO3?H++HCO3- | ||||
| C、用CaSO4治理盐碱地:CaSO4(s)+Na2CO3(aq)?CaCO3(s)+Na2SO4(aq) | ||||
| D、用FeSO4除去酸性废水中的Cr2O72-:Cr2O72-+Fe2++14H+═2Cr3++Fe3++7H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
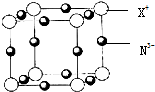 氮是地球上极为丰富的元素.
氮是地球上极为丰富的元素.查看答案和解析>>
科目:高中化学 来源: 题型:
 下表是元素周期表的一部分,表中所列字母分别代表某一化学元素.
下表是元素周期表的一部分,表中所列字母分别代表某一化学元素.| a | b | ||||||||||||||||
| c | d | ||||||||||||||||
| e | f | g | h | i | |||||||||||||
| j | |||||||||||||||||
| 锂 | X | Y | |
| 失去第一个电子 | 519 | 502 | 580 |
| 失去第二个电子 | 7296 | 4570 | 1820 |
| 失去第三个电子 | 11799 | 6920 | 2750 |
| 失去第四个电子 | 9550 | 11600 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、稀醋酸溶液中 |
| B、氢氧化钙悬浊液中 |
| C、二氧化硫与氧气反应的混合物中 |
| D、稀氯化钠水溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、30 min~40 min间该反应使用了催化剂 |
| B、反应方程式中的x=1,正反应为吸热反应 |
| C、30~40min改变的条件是将容器的体积扩大至原来的2倍 |
| D、在25min、35min、55min时化学平衡常数分别为K1、K2、K3,则K1=K2>K3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、39:24:13 |
| B、22:7:14 |
| C、13:8:29 |
| D、26:16:57 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、聚乙烯可发生加成反应 |
| B、丁烷的二氯代物有9种同分异构体 |
| C、淀粉、蛋白质完全水解的产物互为同分异构体 |
| D、纤维素和油脂都是高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
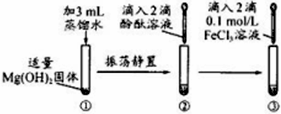
| A、试管②滴入酚酞后溶液可能变浅红 |
| B、试管③滴入FeCl3溶液后有红褐色沉淀生成 |
| C、试管③中的变化是物理变化 |
| D、上述反应说明Fe(OH)3溶解性小于Mg(OH)2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com