
| A. | 在同温同压时,相同体积的任何气体单质所含的原子数目相同 | |
| B. | 常温常压下,32g氧气(O2)和32g臭氧(O3)都含有2NA个氧原子 | |
| C. | 500mL 0.2 mol/L Na2SO4溶液中含有NA个Na+离子 | |
| D. | 通常状况下,22.4 L的氨气和甲烷含有的电子数均为10NA |
分析 A、气体单质可能为单原子分子或双原子分子或三原子分子;
B、氧气和臭氧均由氧原子构成;
C、求出硫酸钠的物质的量,然后根据1mol硫酸钠中含2mol钠离子来计算;
D、通常状况下,气体摩尔体积大于22.4L/mol.
解答 解:A、同温同压下,相同体积的任何气体单质的物质的量均相同,但由于气体单质可能为单原子分子或双原子分子或三原子分子,故含有的原子的数目不一定相同,故A错误;
B、氧气和臭氧均由氧原子构成,故32g氧气和32g臭氧中含有的氧原子的物质的量均为n=$\frac{32g}{16g/mol}$=2mol,个数为2NA个,故B正确;
C、溶液中的硫酸钠的物质的量n=CV=0.2mol/L×0.5L=0.1mol,而1mol硫酸钠中含2mol钠离子,故0.1mol硫酸钠中含0.2mol钠离子即0.2NA个,故C错误;
D、通常状况下,气体摩尔体积大于22.4L/mol,故22.4L混合物气体的物质的量小于1mol,而氨气和甲烷的均为10电子分子,故混合物气体中含有的电子的物质的量小于10mol,个数小于10NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.


科目:高中化学 来源: 题型:解答题
 如图所示,大试管里放入一段光亮无锈的弯成螺旋状的铁丝,试管倒插入液面下,放置约一周后,观察到铁丝发生的变化是铁丝表面形成一层红棕色铁锈.
如图所示,大试管里放入一段光亮无锈的弯成螺旋状的铁丝,试管倒插入液面下,放置约一周后,观察到铁丝发生的变化是铁丝表面形成一层红棕色铁锈.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气有毒,不可用作自来水的杀菌消毒 | |
| B. | FeCl3溶液能与Cu反应,可用于蚀刻印刷电路 | |
| C. | 浓硫酸具有吸水性和强氧化性,可以干燥Cl2,但不能干燥SO2 | |
| D. | 铜的金属活动性比铁弱,可用铜罐代替铁罐贮运浓硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3溶液中c(OH-)=c(H+)+c(HCO3-)+c(H2CO3) | |
| B. | Na2CO3溶液中滴加酚酞呈红色,加热红色变浅 | |
| C. | 0.1mol•L-1的Na2CO3溶液中c(Na+)>2c(CO32-) | |
| D. | 相同温度下,CaCO3在饱和Na2CO3溶液中的KSP比在纯水中的小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在稀盐酸中滴入石蕊试液溶液变红 | |
| B. | 少量胆矾粉末加入到浓硫酸中固体变白色 | |
| C. | SO2通入品红中溶液变为无色 | |
| D. | 红糖水中加入活性炭溶液变为无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 密度:Cs Rb K Na Li | B. | 溶解度:NaHC03 Na2C03 CaC03 | ||
| C. | 氧化性:Li+Na+K+ Rb+Cs+ | D. | 碱性:LiOH NaOH KOH RbOH CsOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ① | B. | ④ | C. | ②③④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
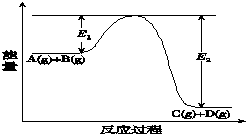 反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示(E1>0,E2>0),回答下列问题.
反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示(E1>0,E2>0),回答下列问题.| t/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.50 | 0.35 | 0.28 | 0.25 | 0.25 | 0.25 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com