
分析 (1)铬24号元素,铬元素失去3个电子变成Cr3+,所以Cr3+核外有21个电子,根据构造原理写出其核外电子排布式;
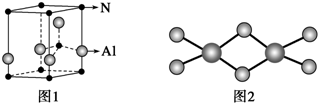
(2)利用均摊法求出晶胞中两种原子的个数,再确定分子式;
(3)根据双聚物Al2Cl6结构确定化学键的类型;
(4)COCl2分子的结构式为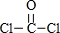 ,双键中含有1个δ键、1个π键,确定碳原子的杂化方式与分子构型.
,双键中含有1个δ键、1个π键,确定碳原子的杂化方式与分子构型.
解答 解:(1)铬24号元素,铬元素失去3个电子变成Cr3+,所以Cr3+核外有21个电子,根据构造原理知,该离子核外电子排布式为:1s22s22p63s23p63d3,
故答案为:1s22s22p63s23p63d3;
(2)氮化铝晶胞中N原子的个数=8×$\frac{1}{8}$+1=2,Al原子的个数=4×$\frac{1}{4}$+1=2,所以氮化铝的化学式为AlN;
故答案为:AlN;
(3)双聚物Al2Cl6形式存在,氯化铝中铝原子最外层电子只有3个电子,每个铝原子和四个氯原子形成共价键,且其中一个共用电子对是氯原子提供,所以含有配位键,则在Al2Cl6中存在的化学键有共价键、配位键,
故答案为:bc;
(4)COCl2分子的结构式为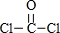 ,C=O中含有1个δ键、1个π键,碳原子的杂化方式为SP2杂化,分子的空间构型为平面三角形;
,C=O中含有1个δ键、1个π键,碳原子的杂化方式为SP2杂化,分子的空间构型为平面三角形;
故答案为:平面三角形.
点评 本题考查物质结构,涉及化学式的确定、杂化方式的确定、核外电子排布式的书写等知识,利用均摊法、价层电子对互斥理论、构造原理来分析解答即可,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 分子中碳原子不在一条直线上 | B. | 光照下能够发生取代反应 | ||
| C. | 正丁烷的沸点比丙烷低 | D. | 丙烷不存在同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 目前城市空气质量恶化原因之一是机动车尾气和燃煤产生的烟气.NO和CO均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应:
目前城市空气质量恶化原因之一是机动车尾气和燃煤产生的烟气.NO和CO均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe元素的化合价升高 | |
| B. | 若27 g Al参加反应则有3 mol电子转移 | |
| C. | Fe2O3发生氧化反应 | |
| D. | Al被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| B. | 用蒸发的方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干 | |
| C. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| D. | 用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全部 | B. | (2)(3)(4) | C. | (1)(2)(3)(5) | D. | (2)(3)(4)(5) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com