
【题目】下图是一种形状酷似罗马两面神Janus的有机物结构简式,化学家建议将该分子叫做“Janusene”,下列说法正确的是
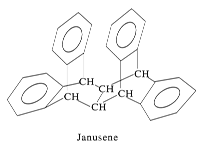
A.Janusene的分子式为C30H20
B.Janusene属于苯的同系物
C.Janusene苯环上的一氯代物有8种
D.Janusene既可发生氧化反应,又可发生还原反应
科目:高中化学 来源: 题型:
【题目】某混合气体由一种气态烷烃和一种气态烯烃(含一个双键)组成,在同温同压下,混合气体对氢气的相对密度13,在标准状况下,将56L混合气体通入足量的溴水中,溴水的质量增重35g。
(1)计算确定混合气体中烃的化学式_____。
(2)混合气体中两种烃的物质的量之比_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究化学反应中能量变化,能更好地利用化学反应为生产和生活服务。
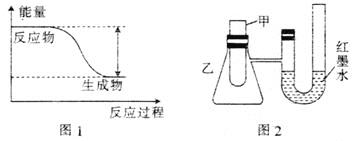
(1)反应Fe+H2SO4=FeSO4+H2↑的能量变化如图1所示。
①该反应为 __________(填“吸热”或“放热”)反应。
②为了探究化学能与热能的转化,某实验小组设计了图2实验装置,在甲试管里先加入适量铁片,再加入稀硫酸,U形管中可观察到的现象是__________。
③若要使该反应的反应速率加快,下列措施可行的是__________(填字母)。
A.铁片改为铁粉 B.稀硫酸改为98%的浓硫酸 C.升高温度
(2)若将上述反应设计成原电池,装置如图3所示。
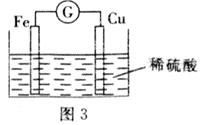
①铜为 __________(填“正”或“负”)极;负极的电极反应式为______。
②若该电池反应过程中共转移0.3 mol电子,则生成的H2在标准状况下的体积是__________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)比较熔点:![]() 晶体_______白磷晶体(填“>”、“<”或“=”),判断的理由是_______________;
晶体_______白磷晶体(填“>”、“<”或“=”),判断的理由是_______________;
(2)酸碱质子理论认为,能电离出质子(氢离子)的物质是酸,能结合质子的物质是碱,用一个离子方程式说明:![]() 与
与![]() 的碱性强弱________________;
的碱性强弱________________;
(3)一水合氨![]() 分子中,
分子中,![]() 与
与![]() 实际上是通过氢键相结合,请结合一水合氨的性质,用结构式画出一水合氨最有可能的分子结构____________。
实际上是通过氢键相结合,请结合一水合氨的性质,用结构式画出一水合氨最有可能的分子结构____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将定量的Na2CO3和NaHCO3的混合物加热到不再放出气体时,收集到CO2aL,冷却后向残余物中加入足量盐酸又收集到CO2 2 aL (体积均在标准状况下测定)。则混合物中Na2CO3和NaHCO3的物质的量之比为( )
A. 1:1 B. 1:2 C. 1:3 D. 1:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组需配制含有NH4+、Cl-、K+、SO42-的植物培养液450mL,且要求该培养液中c(Cl-)=c(K+)=c(SO42-)=0.4mol·L1。实验室提供的药品有:NH4Cl、KCl、(NH4)2SO4、K2SO4和蒸馏水;提供的实验仪器有:①药匙②托盘天平③烧杯④胶头滴管⑤量筒。请回答下列问题:
(1)该植物培养液中,NH4+的物质的量浓度为____。
(2)该研究小组配制该植物培养液时,还须用到的玻璃仪器是____、_____。
(3)若配制该培养液的其他操作均正确,则下列错误操作将使所配制溶液的浓度偏低的是____。
a.将溶液转移至容量瓶后,未洗涤烧杯和玻璃棒
b.将烧杯内的溶液向容量瓶中转移时,容量瓶中还有少量的水
c.将烧杯内的溶液向容量瓶中转移时,因操作不当使部分溶液溅出容量瓶
d.用胶头滴管向容量瓶中加水时,俯视容量瓶刻度线
e.摇匀后发现液面低于容量瓶刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)化合物A是一种不稳定的物质,它的分子组成可用OxFy表示。10mLA气体 能分解生成15mLO2和10mLF2(在同温同压下),A的化学式是_____。
(2)VLFe2(SO4)3溶液中含有agSO42-,取此溶液0.5VL,用水稀释至2VL,则稀释后溶液中 Fe3+的物质的量的浓度为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外研究小组,用含有较多杂质的铜粉,通过不同的化学的反应制取胆矾。其设计的实验过程为:

(1)铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于___上(用以下所给仪器的编号填入,下同),取用坩埚应使___,灼烧后的坩埚应放在___上,不能直接放在桌面上。
a.蒸发皿 b.石棉网 c.泥三角 d.表面皿 e.坩埚钳 f.试管夹
(2)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,用以制取胆矾。灼烧后含有少量铜的可能原因是___。
a.灼烧过程中部分氧化铜被还原
b.灼烧不充分铜未被完全氧化
c.氧化铜在加热过程中分解生成铜
d.该条件下铜无法被氧气氧化
(3)通过途径Ⅱ实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、___、冷却结晶、___、自然干燥。
(4)由粗制氧化铜通过两种斜径制取胆矾,与途径I相比,途径Ⅱ有明显的两个优点是:____。
(5)在测定所得胆矾(CuSO4·xH2O)中结晶水x值的实验过程中,若测定结果x值偏高,可能的原因是___。
a.加热温度过高
b.胆矾晶体的颗粒较大
c.加热后放在空气中冷却
d.胆矾晶体部分风化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ·mol-1
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1452kJ·mol-1
H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ·mol-1
下列说法正确的是( )
A.H2(g)的燃烧热为571.6kJ·mol-1
B.H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
C.3H2(g)+CO2(g)=CH3OH(l)+H2O(l) ΔH=+135.9 kJ·mol-1
D.等质量的H2(g)和CH3OH(l)完全燃烧,H2(g)燃烧放出的热量多
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com