
| A. | 某溶液与NaOH溶液共热,产生使湿润蓝色石蕊试纸变红的气体,则原溶液中存在NH4+ | |
| B. | 某溶液中加入硝酸银溶液时,产生白色沉淀,说明原溶液中含有Cl- | |
| C. | 向溶液中加入稀盐酸,生成能使澄清石灰水变浑浊的无色无味气体,证明原溶液中一定含CO32- | |
| D. | 某溶液中加入BaCl2溶液时,产生白色沉淀,原溶液可能存在Ag+或SO42-或CO32-或SO32- |
分析 A.氨气可使红色石蕊试纸变蓝色;
B.可能生成碳酸银、硫酸银沉淀;
C.可能含有HCO3-;
D.某溶液中加入BaCl2溶液时,产生白色沉淀,可能生成氯化银、硫酸银、碳酸银、碳酸钡、硫酸钡以及亚硫酸钡等沉淀.
解答 解:A.与NaOH溶液共热,产生使湿润红色的石蕊试纸变蓝的气体,说明原溶液中存在NH4+,而不是使蓝色的石蕊试纸变红,故A错误;
B.加入AgNO3溶液有白色沉淀出现,可能生成碳酸银、硫酸银等,因先加入硝酸酸化,故B错误;
C.某固体在加入稀盐酸后产生了无色无味且能使澄清石灰水变浑的气体,该气体为二氧化碳,该固体中可能含有HCO3-,不一定含有CO32-,故C错误;
D.某溶液中加入BaCl2溶液时,产生白色沉淀,可能生成氯化银、硫酸银、碳酸银、碳酸钡、硫酸钡以及亚硫酸钡等沉淀,可能含有Ag+或SO42-或CO32-或SO32-,故D正确.
故选D.
点评 本题考查物质的检验和鉴别,为高频考点,侧重于学生的分析、实验能力的考查,注意把握物质的性质以及实验的严密性、可行性的评价,难度不大.


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:Na2CO3<NaHCO3 | |
| B. | 碱性:Na2CO3<NaHCO3 | |
| C. | 水中的溶解度:Na2CO3>NaHCO3 | |
| D. | 与足量的盐酸反应产生的气体的体积:Na2CO3<NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.7 mol/L | B. | 1.35 mol/L | C. | 0.9 mol/L | D. | 0.45 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解饱和食盐水可以得到氯气 | |
| B. | 金属钠在高温下能将TiCl4中的钛置换出来 | |
| C. | 金属镁燃烧后会发出耀眼的白光,因此常用来制造信号弹和焰火 | |
| D. | 金属镁着火,可用二氧化碳灭火 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
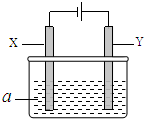 电解原理在化学工业中有广泛应用.如图表示一个电解池,其中a为电解质溶液,X、Y是两块电极板,通过导线与直流电源相连.
电解原理在化学工业中有广泛应用.如图表示一个电解池,其中a为电解质溶液,X、Y是两块电极板,通过导线与直流电源相连.| 方案 | X | Y | a溶液 |
| A | 银 | 石墨 | AgNO3 |
| B | 银 | 铁 | AgNO3 |
| C | 铁 | 银 | AgNO3 |
| D | 铁 | 银 | Fe(NO3)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
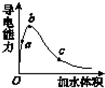 在一定温度下,向冰醋酸中加水稀释,溶液导电能力变化情况如图所示,回答下列问题.
在一定温度下,向冰醋酸中加水稀释,溶液导电能力变化情况如图所示,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com