
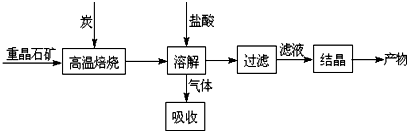
分析 Ⅰ.(1)硫化氢和氢氧化钠溶液反应生成硫化钠和水;
(2)根据盖斯定律书写BaSO4(s)+4C(s)$\frac{\underline{\;高温\;}}{\;}$4CO(g)+BaS(s)△H1=571.2kJ•mol-1 ①
BaSO4(s)+2C(s)$\frac{\underline{\;高温\;}}{\;}$2CO2(g)+BaS(s)△H2=226.2kJ•mol-1 ②
将以上两个热化学方程式相减,然后除以2可得;
(3)加入过量C可提高冰晶石的转化率,同时维持反应进行;
(4)①难溶电解质溶液中存在电离平衡;
②加人Na2SO4后平衡逆向移动,但仍在线上移动;
③蒸发使离子浓度增大,d点不可能到c点;
④d点表示Qc<Ksp,溶液不饱和.
解答 解:Ⅰ.(1)硫化氢和氢氧化钠溶液反应生成硫化钠和水,离子反应方程式为:H2S+2OH-═2S2-+H2O,
故答案为:H2S+2OH-═2S2-+H2O;
(2)BaSO4(s)+4C(s)$\frac{\underline{\;高温\;}}{\;}$4CO(g)+BaS(s)△H1=571.2kJ•mol-1 ①
BaSO4(s)+2C(s)$\frac{\underline{\;高温\;}}{\;}$2CO2(g)+BaS(s)△H2=226.2kJ•mol-1 ②
将以上两个热化学方程式相减,然后除以2可得:
C(s)+CO2(g)$\frac{\underline{\;高温\;}}{\;}$2CO(g)△H=$\frac{571.2KJ/mol-226KJ/mol}{2}$=+172.5kJ•mol-1,
故答案为:+172.5 kJ•mol-1 ;
(3)加入过量C使BaSO4得到充分的还原(或提高BaS的产量),可提高冰晶石的转化率,
故答案为:使BaSO4得到充分的还原(或提高BaS的产量);
(4)①当向含有SO42-的溶液中加入Ba2+使SO42-沉淀完全,此时溶液中还有部分硫酸钡,硫酸钡是强电解质,完全电离,所以溶液中硫酸根离子浓度不是0,故①错误;
②硫酸钡溶液中存在着溶解平衡,a点在平衡曲线上,加入Na2SO4,会增大c(SO42-),平衡左移,c(Ba2+)应降低,故②错误;
③d点时溶液不饱和,蒸发溶剂水,c(SO42-)、c(Ba2+)均增大,故③错误;
④d点表示Qc<Ksp,溶液不饱和,不会有沉淀析出,故④正确;
故选④,
故答案为:④.
点评 本题考查了原电池原理、难溶物的溶解平衡、盖斯定律等知识点,注意原电池中离子的移动方向、难溶电解质在水中的沉淀溶解平衡特点,题目难度中等.


科目:高中化学 来源: 题型:解答题
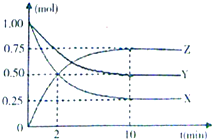 某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.
某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑥ | B. | ②③ | C. | ④⑤ | D. | ①⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在相同的条件下,2mol 氢气与 1 mol 氧气的总能量小于2mol 水蒸气的总能量 | |
| B. | H2(g)+$\frac{1}{2}$O2(g)→H2O(1)+Q1;Q1>241.8kJ | |
| C. | H2(g)+$\frac{1}{2}$O2(g)→H2O(1)+Q2;Q2<241.8kJ | |
| D. | 任何条件下,2L水蒸气分解成2L氢气与1L氧气需吸收483.6kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | .碳的燃烧热△H=-110.5 kJ•mol-1 | |
| B. | .①的反应热为221 kJ•mol-1 | |
| C. | 浓硫酸与稀NaOH溶液反应生成1 mol水,放出的热量为57.3 kJ | |
| D. | .碳的燃烧热大于110.5 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
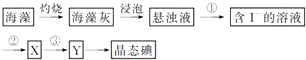

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32克O2所含的原子数目为2NA | |
| B. | 0.5molH2O含有的原子数目为1.5NA | |
| C. | 1molH2O含有的H2O分子数目为NA | |
| D. | 0.5NA个氯气分子的物质的量是1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com