
| A. | 原子半径X>Y>Z | |
| B. | 气态氢化物稳定性X>Y>Z | |
| C. | 元素原子得电子能力由强到弱X>Y>Z | |
| D. | 单质与氢气反应由易到难X>Y>Z |
分析 同周期元素从左到右元素的非金属性逐渐增强,对应的最高价氧化物对应水化物的酸性逐渐增强,酸性相对强弱:HXO4>H2YO4>H3ZO4,可知非金属性X>Y>Z,原子序数X>Y>Z,再结合元素周期律解答.
解答 解:同周期元素从左到右元素的非金属性逐渐增强,对应的最高价氧化物对应水化物的酸性逐渐增强,酸性相对强弱:HXO4>H2YO4>H3ZO4,可知非金属性X>Y>Z,原子序数X>Y>Z.
A.同周期自左而右原子半径减小,故原子半径:X<Y<Z,故A错误;
B.非金属性越强,氢化物越稳定,由于非金属性X>Y>Z,所以气态氢化物的稳定性:X>Y>Z,故B正确;
C.非金属性越强,得电子能力越强,则元素原子得电子能力由强到弱X>Y>Z,故C正确;
D.非金属性X>Y>Z,非金属性越强,单质与氢气反应越容易,故D正确,
故选A.
点评 本题考查元素周期律知识,题目难度不大,注意相关性质的比较角度以及元素周期律的主要递变规律,可以确定具体的元素进行解答.


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 向饱和Na2CO3溶液中通入过量的CO2,溶液中无明显现象 | |
| B. | 检验某溶液是否含有SO${\;}_{4}^{2-}$时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸 | |
| C. | 已知H+(aq)+OH-(aq)═H2O(l);△H=-57.3 kJ/mol.将4 g氢氧化钠固体放入100mL1mol/L的稀盐酸中,放出了5.73 kJ的热量 | |
| D. | 向100ml1mol/L的Ca(HCO3)2 溶液中加入等浓度等体积的NaOH溶液,溶液的碱性减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y分子式中氢原子数不一定要相同,碳原子数必定不同 | |
| B. | 若X为CH4,则相对分子质量最小的Y是甲醇 | |
| C. | 若X为CH4,则相对分子质量最小的Y是乙二醇 | |
| D. | X、Y的化学式应含有相同的氢原子数,且相差n个碳原子,同时相差2n个氧原子(n为正整数) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
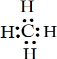
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 实验要求 | 答案 | 供选择的化学试剂及方法 |
| a | 检验乙酸是否具有酸性 | A.新制的氢氧化铜悬浊液 | |
| b | 检验植物油中是否含有碳碳双键 | B.紫色石蕊试液 | |
| c | 检验尿液中是否含有葡萄糖 | C.加入饱和Na2CO3溶液,分液 | |
| d | 除去乙酸乙酯中的少量乙酸 | D.溴水 |

 +4Na→
+4Na→ +2H2↑.
+2H2↑.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CH3COOCH2CH3+H2O,反应类型为酯化反应(或取代反应).
CH3COOCH2CH3+H2O,反应类型为酯化反应(或取代反应). ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 酸铜粉末由无色变为蓝色,生成的气体从F顶端逸出,该气体点燃后可燃烧.
酸铜粉末由无色变为蓝色,生成的气体从F顶端逸出,该气体点燃后可燃烧.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,活化分子百分数增大,化学反应速率加快 | |
| B. | CO2、NH3的水溶液能导电,所以CO2、NH3是电解质 | |
| C. | 干冰升华这一过程中,△S<0 | |
| D. | Na2SO4溶液的导电能力一定比CH3COOH溶液强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com