
【题目】下列化学方程式书写错误的是( )
A.NaHCO3水解的离子方程式:HCO3-+ H2O![]() CO32-+H3O+
CO32-+H3O+
B.NH4Cl水解的化学方程式:NH4Cl+H2O![]() NH3·H2O+HCl
NH3·H2O+HCl
C.Al(OH)3的两性电离方程式:H++AlO2-+H2O![]() Al(OH)3
Al(OH)3![]() Al3++3OH
Al3++3OH
D.NaHSO3的电离方程式:NaHSO3=Na++HSO3-
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】[化学——选修2:化学与技术]
高锰酸钾(![]() )是一种常用氧化剂,主要用于化工、防腐及制药工业等。以软锰矿(主要成分为MnO2)为原料生产高锰酸钾的工艺路线如下:
)是一种常用氧化剂,主要用于化工、防腐及制药工业等。以软锰矿(主要成分为MnO2)为原料生产高锰酸钾的工艺路线如下:
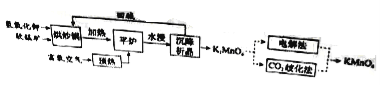
回答下列问题:
(1)原料软锰矿与氢氧化钾按1∶1的比例在“烘炒锅”中混配,混配前应将软锰矿粉碎,其作用是 。
(2)“平炉”中发生的化学方程式为 。
(3)“平炉”中需要加压,其目的是 。
(4)将K2MnO4转化为KMnO4的生产有两种工艺。
①“![]() 歧化法”是传统工艺,即在K2MnO4溶液中通入CO2气体,使体系呈中性或弱碱性,K2MnO4发生歧化反应,反应中生成K2MnO4,MnO2和 (写化学式)。
歧化法”是传统工艺,即在K2MnO4溶液中通入CO2气体,使体系呈中性或弱碱性,K2MnO4发生歧化反应,反应中生成K2MnO4,MnO2和 (写化学式)。
②“电解法”为现代工艺,即电解K2MnO4水溶液,电解槽中阳极发生的电极反应为
,阴极逸出的气体是 。
③“电解法”和“![]() 歧化法”中,K2MnO4的理论利用率之比为 。
歧化法”中,K2MnO4的理论利用率之比为 。
(5)高锰酸钾纯度的测定:称取1.0800 g样品,溶解后定容于100 mL容量瓶中,摇匀。取浓度为0.2000 mol·L1的H2C2O4标准溶液20.00 mL,加入稀硫酸酸化,用KMnO4溶液平行滴定三次,平均消耗的体积为24.48 mL,该样品的纯度为
(列出计算式即可,已知2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一体积为2L的恒容密闭容器里充入1 mol N2和4 molH2,在一定温度下发生反应: N2(g)+3H2(g)![]() 2NH3(g);△H<0。10秒后达到平衡,c(NH3)为0.4mol/L。下列说法正确的是
2NH3(g);△H<0。10秒后达到平衡,c(NH3)为0.4mol/L。下列说法正确的是
A. 该反应达平衡时H2的转化率为40%
B. 降低温度能使混合气体的密度增大
C. 向该容器中充入N2,平衡正向移动
D. 研发高效催化剂可大大提高N2的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成填空。
(1)NaHCO3电离方程式:______________________________________________
(2)过氧化钠与水反应的离子方程式:__________________________________________
(3)配平方程式:______NH4NO3![]() ______ HNO3 +_____ N2↑+______ H2O;在反应中被氧化与被还原的氮原子的个数比为________
______ HNO3 +_____ N2↑+______ H2O;在反应中被氧化与被还原的氮原子的个数比为________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)25 ℃时,0.1 mol·L-1NaOH溶液的pH为________;
(2)25 ℃时,0.1 mol·L-1NH4Cl溶液的pH________7(填“<”、“=”或“>”),其原因是__________________(用离子方程式表示);
(3)将上述两种溶液等体积混合后,离子浓度大小次序正确的是________(填序号)。
A.[Na+]>[Cl-]>[OH-]>[H+] |
B.[Na+]=[Cl-]>[H+]>[OH-] |
C.[Na+]=[Cl-]>[OH-]>[H+] |
D.[Cl-]>[Na+]>[OH-]>[H+] |
(4)25 ℃时,0.1 mol·L-1NaOH溶液中水电离出来的氢氧根的浓度为C1,0.1 mol·L-1NH4Cl溶液中水电离出来的氢离子的浓度为C2,则C1______C2(填“<”、“=”或“>”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠与二氧化碳能生成氧气,在潜水艇中做制氧剂。某学生为了验证这一实验,利用足量的大理石、盐酸和1.95g Na2O2,制取O2。设计出如下图实验装置
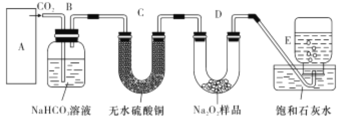
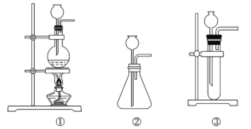
(1)A中制取CO2的图,应选用________(填①或②或③)
写出本题中制取氧气的化学方程式__________________B装置的作用是___________________
(2)若E中的出现少量白色沉淀,说明原因:__________________________________
(3)若D中1.95g Na2O2接近反应完毕时,预测会有何种现象:_______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究金属桥墩腐蚀及防护是跨海建桥的重要课题。下列判断中正确的是

A. 用装置①模拟研究时未见a上有气泡产生,说明铁棒没有被腐蚀
B. ②中桥墩与外加电源正极连接能确保桥墩不被腐蚀
C. ③中采用了牺牲阳极的阴极保护法保护桥墩
D. ①②③中海水均是实现化学能转化为电能的电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子核外p能级、d能级等原子轨道上电子排布为“全空”“半满”“全满”的时候一般更加稳定,称为洪特规则的特例。下列事实不能作为这个规则的证据的是( )
A.硼元素的第一电离能小于铍元素的第一电离能
B.磷元素的第一电离能大于硫元素的第一电离能
C.基态铜原子的核外电子排布式为![]() 而不是
而不是![]()
D.某种激发态碳原子的核外电子排布式为![]() 而不是
而不是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把在空气中久置的铝片5.0 g投入盛有500 mL 0.5 mol/L硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间的关系可用如图所示的坐标曲线来表示,请回答下列问题:
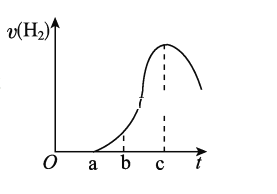
(1)曲线由O→a段不产生氢气的原因是___________________________,有关的化学方程式为___________________________________________。
(2)曲线由a→c段,产生氢气的速率增加较快的主要原因是_____________________。
(3)曲线由c以后,产生氢气的速率逐渐下降的主要原因是_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com