
| A. | R可能为乙二酸 | |
| B. | N可能为对苯二甲酸 | |
| C. | 高聚物M为加聚产物 | |
| D. | 含有羧基的物质在常温下均易溶于水 |
分析 高聚物M在氢氧化钠浓溶液中,发生水解反应,加硫酸酸化得到N为酸,R为醇,且N中含有苯环,N、R分子中均含有两种不同化学环境的氢原子,则N为 时,R为OHCH2CH2OH,或N为
时,R为OHCH2CH2OH,或N为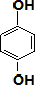 时R为HOOCCH2CH2COOH,M为缩聚反应生成的高分子,以此来解答.
时R为HOOCCH2CH2COOH,M为缩聚反应生成的高分子,以此来解答.
解答 解:由上述分析可知,N为 时,R为OHCH2CH2OH,或N为
时,R为OHCH2CH2OH,或N为 时R为HOOCCH2CH2COOH,
时R为HOOCCH2CH2COOH,
A.R不可能为乙二酸,且乙二酸中含1种H,故A错误;
B.N可能为对苯二甲酸,故B正确;
C.-OH、-COOH发生缩聚反应生成M,则高聚物M为缩聚产物,故C错误;
D.含有羧基、且烃基较大的物质不溶于水,故D错误;
故选B.
点评 本题考查有机物的推断,为高频考点,把握高分子化合物的合成方法、N与R的结构为解答的关键,侧重分析与推断能力的考查,注意选项D为易错点,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 1molCl2与Fe粉完全反应时转移电子数为2NA | |
| B. | 过氧化钠与水反应时,每生成1molO2,转移4mol电子 | |
| C. | 标准状况下,11.2L氟化氢中含有氟原子的数目为0.5NA | |
| D. | 0.1 mol•L-1NaHSO4溶液中,阳离子数目之和为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚钠溶液中通入CO2: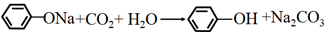 | |
| B. | 常温下CH2=CHCH3与水接触:CH2=CHCH3+H2O→CH3CH(OH)CH3 | |
| C. | 乙醇和金属钠发生反应放出氢气:2CH3CH2OH+2 Na→2CH3CH2ONa+H2↑ | |
| D. | 甲苯与氯气在铁粉催化作用下发生反应: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇能发生取代反应和加成反应 | |
| B. | 1mol 3-(2-噻吩)丙烯酸(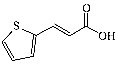 )发生加成反应时最多消耗3mol H2 )发生加成反应时最多消耗3mol H2 | |
| C. | 淀粉和纤维素的分子通式均为(C6H10O5)n,故淀粉和纤维素互为同分异构体 | |
| D. | 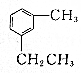 与 与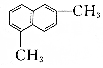 都属于芳香烃,二者互为同系物 都属于芳香烃,二者互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 刚玉、红宝石主要成分是氧化铝,陶瓷,分子筛主要成分是有机物高分子化合物 | |
| B. | 石油原油的脱水,有色玻璃、纳米材料、塑料、橡胶及合成纤维等制造过程都会用到胶体 | |
| C. | 碳酸钙分解、氢氧化钡晶体和氯化铵固体反应、高温下铝与氧化铁反应都是吸热反应 | |
| D. | 风化、钝化、皂化、焰色反应都是化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 64gCaC2中含有的共用电子对数为3NA | |
| B. | 标准状况下,11.2L己烷中含有的碳碳键数为2.5NA | |
| C. | 4.6gNO2在标准状况下,含有的分子数为0.1NA | |
| D. | 50mL12 mol•L-1盐酸与足量MnO2共热,转移的电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用玻璃棒蘸取NaClO溶液点在干燥的PH试纸上,试纸呈现蓝色,证明HClO是弱酸 | |
| B. | 将一定量的FeCl3晶体、盐酸依次加入容量瓶中,配制一定物质的量浓度的FeCl3溶液 | |
| C. | 为证明Cu与浓硫酸反应生成了CuSO4,可将反应后的混合液冷却后再加入水,若显色即可证明生成了CuSO4 | |
| D. | 用乙醇、乙酸及浓硫酸制取乙酸乙酯的过程中发现忘加碎瓷片,需在完全冷却后再补 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
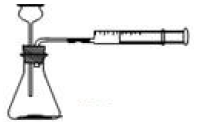 甲同学用0.1×10×25mm、质量分数≥99.5%的铝片和盐酸用下图装置反应制取H2,实验现象如表:
甲同学用0.1×10×25mm、质量分数≥99.5%的铝片和盐酸用下图装置反应制取H2,实验现象如表: | 1min | 2min | 5min | 15min | 20min |
| 3mol•L-1HCl | 少量气泡 | 较多气泡 | 大量气泡 | 反应剧烈 | 铝片耗尽 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com