
����Ŀ����������Ũ�Ⱦ�Ϊ0.5 mol��L-1��������Һ����Na2CO3��Һ ��NaHCO3��Һ ��HCl��Һ �ܰ�ˮ
��1��������Һ�У����ʿɷ���ˮ�����_______________������ţ���
��2�������������������Ʒ�Ӧ�����ܺ����ᷴӦ����Һ�У�����Ũ���ɴ�С��˳��Ϊ_____��
��3������м��������Ȼ�粒��壬��ʱ��Һ��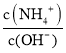 ��ֵ____________ ������������������С����������������
��ֵ____________ ������������������С����������������
��4�������ۺܻ͢�Ϻ���Һǡ�ó����ԣ�����ǰ�۵����________�ܵ��������������������С��������������������ʱ��Һ������Ũ���ɴ�С��˳����_____________��
��5��ȡ10 mL�ۣ���ˮϡ�͵�500 mL�����ʱ��Һ����ˮ�������c(H��)��________��
���𰸡��٢� c(Na+)>c (HCO3-)>c (OH-)>c (H+)>c (CO32-) ���� С�� c(NH4+)=c(Cl-)>c(OH-)=c(H+) 10��12 mol��L-1
��������
(1)���������ӵ����ܷ���ˮ�⣻
(2)�⼸�������У��ܺ�ǿ�ǿ�ᷴӦ������Ϊ�������ʽ�Σ�Ϊ̼�����ƣ�HCO3-����̶�С��ˮ��̶ȣ�����Һ�ʼ��ԣ�ˮҲ�ܵ���������Ӻ����������ӣ��ݴ�����
(3)��ˮ�м����Ȼ������һˮ�ϰ��ĵ��룻
(4)�Ȼ��Ϊǿ�������Σ�����Һ�����ԣ�Ҫʹ����Ͱ�ˮ��Һ�����ԣ���ˮӦ������������ϵ���غ��ж�����Ũ�ȴ�С��
(5)ȡ10mL��Һ��HCl��Һ����ˮϡ�͵�500mL����ҺŨ��Ϊԭ����![]() ��Ϊ0.01mol/L�����ˮ�����ӻ�����������
��Ϊ0.01mol/L�����ˮ�����ӻ�����������
(1)���������ӵ����ܷ���ˮ�⣬̼���ƺ�̼�����ƶ��Ǻ��������ӵ��Σ��ܷ���ˮ�⣬�ʴ�Ϊ�٢ڣ�
(2)�⼸�������У��ܺ�ǿ�ǿ�ᷴӦ��������̼�����ƣ�HCO3-ˮ��̶ȴ��ڵ���̶ȣ����̶ȶ���С����Һ�ʼ��ԣ���Һ��HCO3-��ˮ���������������ӣ�����Һ������Ũ�ȴ�С˳����c(Na+)��c(HCO3-)��c(OH-)��c(H+)��c(CO32-)���ʴ�Ϊc(Na+)��c(HCO3-)��c(OH-)��c(H+)��c(CO32-)��
(3)��ˮ�м����Ȼ�泥���Һ��笠�����Ũ����������һˮ�ϰ����룬����������Ũ�ȼ�С������ ��ֵ���ʴ�Ϊ����
��ֵ���ʴ�Ϊ����
(4)�Ȼ��Ϊǿ�������Σ�����Һ�����ԣ�Ҫʹ����Ͱ�ˮ��Һ��Ӧ�����ԣ���ˮӦ������������Һ�����ԣ���c(OH-)=c(H+)�����ݵ���غ��c(Cl-)=c(NH4+)��������Һ��ˮ�ĵ���̶Ⱥ�С����������Ũ�ȴ�С˳����c(Cl-)=c(NH4+)��c(OH-)=c(H+)���ʴ�ΪС�ڣ�c(Cl-)=c(NH4+)��c(OH-)=c(H+)��
(5)ȡ10mL��Һ�ۣ���ˮϡ�͵�500mL����ҺŨ��Ϊԭ����![]() ��c(HCl)=0.5mol/L��
��c(HCl)=0.5mol/L��![]() =0.01mol/L����Kw=c(OH-)c(H+)��֪��c(OH-)=10-12 molL-1�����ʱ��Һ����ˮ�������c(H+)=10-12 molL-1���ʴ�Ϊ10-12 molL-1��
=0.01mol/L����Kw=c(OH-)c(H+)��֪��c(OH-)=10-12 molL-1�����ʱ��Һ����ˮ�������c(H+)=10-12 molL-1���ʴ�Ϊ10-12 molL-1��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������³������һ�ֳ����ľֲ����������ڴ�����������������������Ʒ��о������õ�ҩЧ����ϳ�·�����£�

��֪����A�ĺ˴Ź�������Ϊ���壬CΪ��������
��������³����Ľṹ��ʽΪ��![]() ��
��
��![]() ��
��![]()
���Ȼ�Ϊ��λ��λ������Ϊ��/��λ��λ����
��ش��������⣺
��1��A�Ľṹ��ʽΪ_______��C�Ļ�ѧ����Ϊ_______��
��2����Ӧ�١��۵ķ�Ӧ���ͷֱ�Ϊ______��______��
��3����Ӧ�ݵĻ�ѧ����ʽΪ_______��
��4��G��F��ͬϵ�����Է���������FС14��G��ͬ���칹����ͬʱ��������������
��1���Ӹ����ʿ�ˮ������2����CH3CH2OH���ڱ�����ֻ��һ�ֻ�ѧ������H������______��(�����������칹)��������д������һ�ֵĽṹ��ʽ_______��
��5��д���üױ�Ϊԭ���Ʊ�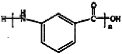 �ĺϳ�·��_______(���Լ���ѡ)��
�ĺϳ�·��_______(���Լ���ѡ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ƾ���(CaO2��8H2O)������ҽҩ����������������̼���Ϊԭ�ϣ�������ʵ�鷽�����Ʊ���
![]()
�����й�˵����ȷ����
A. ����е���ҪĿ����Ϊ�˳�ȥ�ܽ��CO2
B. �ڵķ�Ӧ��H2O2������������ˮ����������Һ��pH
C. ���нᾧ�Ŀ�����С������ʱ���ò������������
D. �۴�ϴ����ҪĿ����Ϊ�˼��پ������ʧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Һ��pH=6��������Һ��pH=2��������������ȷ����
A.�ס�������Һ��c(H+)֮��Ϊ400��1
B.�ס�������Һ��������
C.����ˮ�ĵ���̶ȴ�������ˮ�ĵ���̶�
D.�ס�������Һ�������Ϻ���Һ��pH=4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���л�������ģ����ͼ(ͼ�й���ʾ������˫��������)�����ڸ��л����˵����ȷ���ǡ�
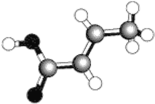
A.�����ģ�ͱ�ʾ�Ļ�ѧʽΪC6H6
B.���л���ֻ�ܷ���ȡ����Ӧ�ͼӳɷ�Ӧ���ַ�Ӧ
C.���л����ʹ��ˮ��ɫ,������ʹ���Ը��������Һ��ɫ
D.���л��ﲻ�������ͬϵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶�����һ��2 L�ĺ����ܱ������з�����Ӧ4A(s)+3B(g)2C(g)+D(g)����2 min��ƽ��״̬����ʱB��Ӧ������0.9 mol������˵����ȷ����
A. ƽ��ʱ��v(A)��v(B)��v(C)��v(D) =4��3��2��1
B. �������ƽ����Է�����������Ϊƽ���־
C. �����������ʹѹǿ����ɼӿ췴Ӧ����
D. C��ƽ����Ӧ����Ϊ0.5 mol/(L��min)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�Ͽ��ڸߴ��Ȱ����£�ͨ����ĥ�⻯﮵ķ�ʽ�ϳɸߴ��ȵĴ�����ϰ���ﮣ��ù����з�����Ӧ��LiH(s)+NH3(g)=LiNH2(s)+H2 (g)����ͼ��ʾ��0.3 MPa�£���ͬ��ĥʱ���Ŀ�����LiNH2����Դ��ȱ仯���ߡ�����˵����ȷ���� ( )
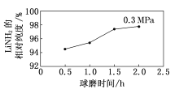
A.��ҵ�����У���0.3 MPa�ºϳ�LiNH2�������ĥʱ����2.0 h
B.Ͷ�붨���ķ�Ӧ�ƽ��ʱ��������ƽ��Ħ������Խ��LiNH2����Դ���Խ��
C.��0.3 MPa�£���ƽ��ʱH2�����ʵ�������Ϊ60%����÷�Ӧ��ƽ�ⳣ��K=1.5
D.LiH��LiNH2������ˮ��Һ���ȶ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���úϳ�EPR��![]() �����ֵ���A��B�ϳ�PC����
�����ֵ���A��B�ϳ�PC����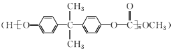 ��ϳ�·�����£�
��ϳ�·�����£�
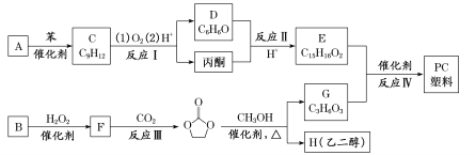
��֪����RCOOR1+R2OH![]() RCOOR2+R1OH
RCOOR2+R1OH
��(CH3)2C=CHCH3+H2O2![]()
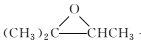 +H2O
+H2O
��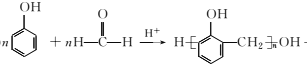 +(n-1)H2O
+(n-1)H2O
�ش��������⣺
(I)F�Ľṹ��ʽΪ__________����Ӧ��ķ�Ӧ����Ϊ___________��
(2)C������Ϊ__________��
(3)д����Ӧ���Ļ�ѧ����ʽ��____________________��
(4)������ѡ����ѡ��______�Լ�������һ���Լ���D��G��H�������ʡ�������ĸ��
A.�Ȼ�����Һ B.Ũ��ˮ C.����KMnO4��Һ
(5)���������������л���E��ͬ���칹����__________�֡�
����E����ͬ������ʣ��ں˴Ź���������6��壬�������Ϊ1��1��1��1��1��3��
(6)�Ա�ϩ�ͱ�ͪΪԭ�Ϻϳ�![]() �����Լ���ѡ��д���ϳ�·��__________________________���ýṹ��ʽ��ʾ�л���ü�ͷ��ʾת����ϵ����ͷ��ע���Լ��ͷ�Ӧ��������
�����Լ���ѡ��д���ϳ�·��__________________________���ýṹ��ʽ��ʾ�л���ü�ͷ��ʾת����ϵ����ͷ��ע���Լ��ͷ�Ӧ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ҫ�ɷ���![]() ����
����![]() ��
��![]() ��MgO�����ʣ�����ȡ���ֹ���Ʒ���������£�
��MgO�����ʣ�����ȡ���ֹ���Ʒ���������£�

��ش��������⣺
��1�����̼������������Al3+�ķ���ʽΪ_________.
��2�������Ҽ����ռ������SiO32-�����ӷ���ʽΪ________.
��3����֤��ҺB��![]() ����ȡ������Һ������________�����Լ����ƣ���
����ȡ������Һ������________�����Լ����ƣ���
��4����ҺE��K�����ʵ���Ҫ�ɷ���________(�ѧʽ)��д������Һ��һ����;________
��5����֪298Kʱ��![]() ���ݶȻ�����
���ݶȻ�����![]() =5.6��
=5.6��![]() ,ȡ��������ҺB,����һ�������ռ�ﵽ������Һƽ�⣬���PH=13.00������¶��²�������Һ�е�
,ȡ��������ҺB,����һ�������ռ�ﵽ������Һƽ�⣬���PH=13.00������¶��²�������Һ�е�![]() =_______.
=_______.
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com