
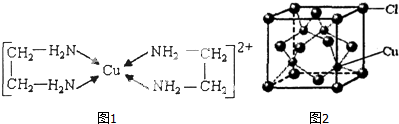
分析 (1)根据铜的原子序数为29,结合能量最低原理书写基态原子的电子排布式;
(2)根据SO2晶体为分子晶体,而CuCl晶体为离子晶体比较熔点高低;根据判断SO2分子含有的δ键以及孤电子对数判断空间构型;
(3)根据价层电子对数判断乙二胺分子中氮原子的杂化类型,根据是否含有氢键分析二者熔沸点高低;
(4)根据成键原子的特点判断化学键类型;
(5)根据晶体结构特点分析Cl原子的配位数.
解答 解:(1)铜的原子序数为29,根据能量最低原理其态原子的电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1,故答案为:1s22s22p63s23p63d104s1或[Ar]3d104s1;
(2)因为SO2晶体为分子晶体,而CuCl晶体为离子晶体,所以SO2晶体的熔点比CuCl晶体低;SO2分子中含有2个δ键,孤电子对数=$\frac{6-2×2}{2}$=1,所以分子为V形;
故答案为:低;V形;
(3)乙二胺分子中氮原子形成4个δ键,价层电子对数为4,氮原子为sp3杂化,乙二胺分子间可以形成氢键,物质的熔沸点较高,而三甲胺分子间不能形成氢键,熔沸点较低,
故答案为:sp3杂化;高;
(4)②中所形成的配离子中含有的化学键中N与Cu之间为配位键,C-C键为非极性键,C-N、N-H、C-H键为极性键,不含离子键,故答案为:abd;
(5)从CuCl的晶胞可以判断,每个铜原子与4个Cl距离最近且相等,即Cu的配位数为4,根据化学式可知Cl的配位数也为4,故答案为:4.
点评 本题考查较为综合,涉及电子排布式、分子的立体构型、杂化轨道类型、氢键、化学键类型以及晶体结构分析等知识,题目具有一定难度,本题注意晶胞配位数的判断方法,可根据CuCl的化学式进行比较.


 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
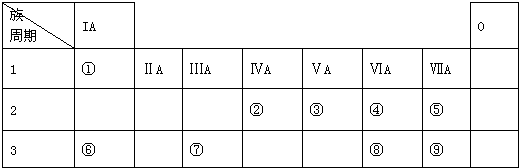
| A. | 除⑥外 | B. | 除⑥、⑦外 | C. | 除⑥、⑦、⑧外 | D. | 除①、②、③、④、⑤外 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 粒子半径:Na+>Mg2+>S2->Cl- | B. | 热稳定性:SiH4<PH3<H2S<HCl | ||
| C. | 碱性强弱:KOH>NaOH>LiOH | D. | 还原性:HF<HCl<HBr<HI |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 有一澄清的碱性溶液,做离子鉴定时得出的结论是含有:Al(OH)4-、Fe3+、HCO3- | |
| B. | 某一固体溶于水后,检验出含有K+、NO3-、Na+、Cl-等离子,则该固体混合物是KNO3和NaCl的混合物或KCl和NaNO3的混合物 | |
| C. | 固体NaOH吸收了空气中的二氧化碳并溶于水后,则溶液中就一定大量存在碳酸根离子 | |
| D. | 加热碳酸氢铵固体,将生成的气体通过碱石灰能制备NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 杂化前后的轨道数不变,但轨道的形状发生了改变 | |
| B. | sp3、sp2、sp杂化轨道的夹角分别为109°28′、120°、180° | |
| C. | 部分四面体形、三角锥形、V形分子的结构可以用sp3杂化轨道解释 | |
| D. | 杂化轨道全部参加形成化学键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com