
 乙二醛电解氧化制备乙醛酸(OHC-COOH)的生产装置如图所示,通电后,阳极产生的Cl2与乙二醛溶液反应生成乙醛酸.
乙二醛电解氧化制备乙醛酸(OHC-COOH)的生产装置如图所示,通电后,阳极产生的Cl2与乙二醛溶液反应生成乙醛酸.分析 (1)阴极是氢离子放电生成氢气;
(2)增强溶液导电性;
(3)通过总电量为60ta C,再计算电极上通过电子总物质的量;计算生成乙醛的物质的量,根据C元素化合价变化计算消耗电子物质的量,电解中的电流效率.
解答 解:(1)阴极是氢离子放电生成氢气,电极反应式为:H++2e-=H2↑,故答案为:H++2e-=H2↑;
(2)阳极液中盐酸可以增强溶液导电性,故答案为:增强溶液导电性;
(3)电极通过总电量为60t s×a A=60ta C,则电极上通过电子总物质的量=$\frac{60ta}{f}$mol;生成乙醛酸的物质的量为$\frac{mg}{74g/mol}$=$\frac{m}{74}$mol,醛基转化为羧基,C原子化合价升高2价,消耗电子物质的量2×$\frac{m}{74}$mol,故电解中的电流效率η=$\frac{2×\frac{m}{74}}{\frac{60ta}{f}}$×100%=$\frac{5mf}{111at}$%,故答案为:$\frac{5mf}{111at}$%.
点评 本题考查电化学的知识电极原理、电极反应方程式的书写等,难度中等,学生只要学会应用公式求可以解题.


科目:高中化学 来源: 题型:解答题
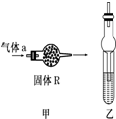 干燥管在不同情况下常具有多种功能.下列两种不同图示就分别代表了干燥管的不同应用.请回答有关问题:
干燥管在不同情况下常具有多种功能.下列两种不同图示就分别代表了干燥管的不同应用.请回答有关问题:| A | B | C | D | |
| 气体a | NH3 | SO2 | C2H4 | Cl2 |
| 固体R | 碱石灰 | 浓硫酸 | 高锰酸钾 | 碱石灰 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某溶液中加入盐酸,产生的气体能使石灰水变浑浊,该溶液中一定含有CO32- | |
| B. | 某溶液中加入硝酸酸化的BaCl2,产生白色沉淀,该溶液中一定含有SO42- | |
| C. | 用洁净的铂丝蘸取某溶液在酒精灯上灼烧,产生黄色火焰,溶液中一定含Na+,一定不含K+ | |
| D. | 某溶液中加入NaOH溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,该溶液中一定含有NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
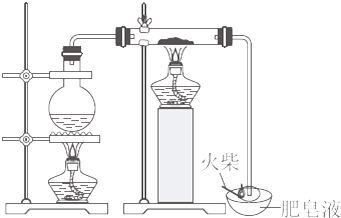
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
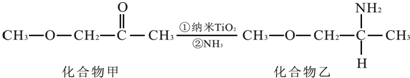
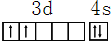 ,其原子核外共有22种运动状态不相同的电子.
,其原子核外共有22种运动状态不相同的电子.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
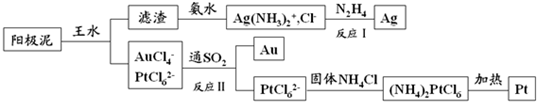
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2 L的苯所含的分子个数为0.5NA | |
| B. | 28 g乙烯所含共用电子对数目为4NA | |
| C. | 标准状况下,11.2 L二氯甲烷所含原子个数为2.5NA | |
| D. | 现有乙烯、丙烯、丁烯的混合气体共14 g,其原子个数为3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com