
“酸化”是实验中经常采用的方法,下列酸化正确的是
A.抑制Fe2+的水解,用稀硝酸酸化
B.提高高锰酸钾的氧化能力,用盐酸酸化
C.确认溶液中含有SO42—时,用盐酸酸化,再检验
D.检验氯代烃中含氯 ,加碱溶液加热后,用硫酸酸化,再检验
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2014-2015学年上海市普陀区高三一模化学试卷(解析版) 题型:选择题
关于合成氨反应中平衡常数的讨论,一定正确的是
A.平衡常数越大,则H2转化率越大
B.平衡常数越小,则平衡向逆反应方向移动
C.只改变某一条件使平衡常数增大,则正反应速率增大
D.只改变某一条件使平衡常数减小,则H2转化率减小
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市嘉定区高三一模化学试卷(解析版) 题型:选择题
下列有关电子云和原子轨道的说法正确的是
A.原子核外的电子象云雾一样笼罩在原子核周围,故称电子云
B.s亚层的原子轨道呈球形,处在该轨道上的电子只能在球壳内运动
C.p亚层的原子轨道呈纺锤形,随着电子层数的增加,p亚层原子轨道也在增多
D.s、p电子原子轨道的平均半径随电子层的增大而增大
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市虹口区高三上学期期末考试化学试卷(解析版) 题型:选择题
将一定量的H2、CO和CO2的混合气体通入盛有足量Na2O2粉末(Na2O2体积忽略不计)的密闭容器中,用电火花引燃直至反应完全。恢复到原温度,容器内的压强为原来的1/4,则原混合气体的平均相对分子质量可能是
A.20 B.23 C.30 D.36
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市虹口区高三上学期期末考试化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值。下列说法正确的是
A.常温常压下,14 g由N2与CO组成的混合气体含有的原子数目为NA
B.78 g苯含有C= C双键的数目为3 NA
C.1 L 1 mol·L-1的NaClO溶液中含有ClO-的数目为NA
D.标准状况下,6.72 L NO2与水充分反应转移的电子数目为0.1 NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市长宁区高三上学期教学质量检测化学试卷(解析版) 题型:计算题
(本题共14分)氨在工业生产中有广泛的用途。
54.某工厂平均每天产生约600 m3废氨水(该氨水浓度为153 mg/L,密度为1 g/cm3),该废氨水中氨的物质的量浓度为_____________。
55.若含0.800 mol NH3的某氨水溶液质量为54.0 g,向该溶液通入二氧化碳至反应完全,析出晶体后过滤,得到滤液31.2g,则NH4HCO3的产率为_______%。(保留1位小数)
56.NH3常用于制备NO。4NH3+5O2 →4NO+6H2O;(不考虑NO与氧气的反应),设空气中氧气的体积分数为0.20,氮气体积分数为0.80。为使NH3恰好完全氧化为NO,氨—空气混合物中氨的体积分数为________。
57.硫酸工业的尾气可以使用氨水进行吸收,既防止了有害物质的排放,也同时得到副产品氮肥。已知吸收尾气后的氨水全部转化为铵盐。取两份相同体积的铵盐溶液,一份中加入足量硫酸,产生0.09mol SO2(假设气体已全部逸出,下同);另一份中加入足量Ba(OH)2,产生0.16mol NH3,同时得到21.86g沉淀。通过计算,求铵盐溶液中各溶质成分与物质的量浓度之比。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市长宁区高三上学期教学质量检测化学试卷(解析版) 题型:选择题
现将金属镁和铝的混合物7.5g完全溶解于一定浓度足量的硝酸溶液中,收集反应产生的A 气体。向所得溶液中加入过量烧碱溶液,得到沉淀11.6 g。则气体A的成分可能是
A.0.2mol NO和0.1mol NO2
B.0.3 mol NO
C.0.1mol NO、0.2mol NO2和0.1mol N2O4
D.0.3 mol NO2和0.1mol N2O4
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市长宁区高三上学期教学质量检测化学试卷(解析版) 题型:选择题
有关元素及其化合物的化学用语正确的是
A.CO2的电子式: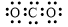
B.NaClO的结构式:Na—O—Cl
C.醋酸钠的分子式:C2H3O2Na
D.乙烯的比例模型:
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东师大附中高三第四次模拟考试理综化学试卷(解析版) 题型:实验题
(20分)实验室中,用硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2等)为原料制备高纯氧化铁( —
—

Fe2O3)的步骤如下:
回答下列问题:
(1)上述实验中,加入铁粉的作用是____________。(用离子方程式表示)实验中检验溶液x中的离子是否与铁粉完全反应的试剂是____________溶液
(2)实验室欲用18.4 mol·L-1。的浓硫酸配制100 mL5.0mol·L-1的硫酸溶液,所用仪器除胶头滴管、量筒、烧杯、玻璃棒外,还有_________(填写仪器名称);
(3)某同学用下图所示装置实现向溶液Y中通入NH3和CO2

①上述装置的中,仪器a的名称是_______;装置B的作用是____________________。
②圆底烧瓶内放置的固体药品为________(填化学式);试管内发生反应的化学方程式为_________________。
③甲、乙、丙三位同学分别用上述装置进行实验,装置C的试剂瓶内溶液体积相等。
若甲、乙两同学实验中,通入的NH3和CO2的物质的量之比分别为2:l和l:l,恰好完全反应后,溶液中水的电离程度 ________(填“>”“=”或“<”)
________(填“>”“=”或“<”) 。
。
若丙同学未用装置D,则反应后溶液中离子浓度间的关系为[H+]+[NH4+]=_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com