
| A. | Na2O2 | B. | H2O | C. | MgCl2 | D. | N2 |
分析 活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,含有离子键的化合物是离子化合物,据此分析解答.
解答 解:A.过氧化钠中钠离子和过氧根离子之间存在离子键、O-O原子之间存在共价键,故A正确;
B.水分子中H-O原子之间只存在共价键,为共价化合物,故B错误;
C.氯化镁中镁离子和氯离子之间只存在离子键,为离子化合物,故C错误;
D.氮气分子中N-N原子之间只存在共价键,为单质,故D错误;
故选A.
点评 本题考查化学键、化合物类型判断,为高频考点,明确物质中存在的化学键及化合物类型与化学键的关系是解本题关键,易错选项是C,注意氯化镁中两个氯离子之间不存在化学键.


 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
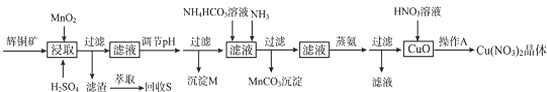
| 离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe3+ | 1.1 | 3.2 |
| Mn2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;另一种没有支链且能被氧化成醛,写出它与乙酸发生酯化反应的方程式CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH2CH2CH3+H2O.
;另一种没有支链且能被氧化成醛,写出它与乙酸发生酯化反应的方程式CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH2CH2CH3+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热能减慢反应速率 | |
| B. | 增大压强能加快反应速率 | |
| C. | 反应达到平衡时,v(正反应)=v(逆反应)=0 | |
| D. | 反应达到平衡时,N2转化率为100% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 氟化物 | G的氟化物 | Q的氟化物 | R的氟化物 |
| 熔点/K | 993 | 1539 | 183 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B和D、C和D组成的常见化合物中化学键的类型相同 | |
| B. | 同周期元素中D的最高价氧化物对应水化物的酸性最强 | |
| C. | 氢化物的热稳定性:HnB<HnD | |
| D. | 离子半径的大小顺序:rD>rB>rC>rA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com