

| 20.0g |
| 25.0g |


科目:高中化学 来源: 题型:
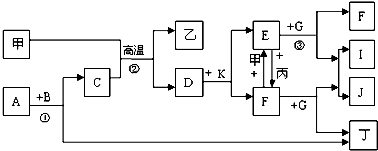
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若x=l,两个容器体积相同,则平衡2中E的物质的量为a mol |
| B、若x=1,两个容器压强相同,则平衡2中E的平衡浓度为a mol?L-1 |
| C、若x=2,两个容器体积相同,则平衡2中E的平衡浓度为a mol?L-1 |
| D、若x=2,两个容器压强相同,则平衡2中E的体积分数为50% |
查看答案和解析>>
科目:高中化学 来源: 题型:
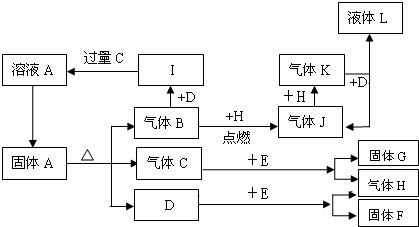
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、图I研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高 |
| B、图Ⅱ研究的是压强对反应的影响,且乙的压强较高 |
| C、图Ⅲ研究的是温度对反应的影响,且甲的温度较高 |
| D、图 IV研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com